الکترون ظرفیت (الکترون والانس) الکترون یا الکترونهایی است که در بیرونیترین لایه الکترونی اتمها قرار دارد و مسئولیت شرکت در واکنشهای شیمیایی و تشکیل پیوند را بر عهده دارد. این الکترونها از هسته اتم که شامل پروتون و نوترون است، بیشترین فاصله را دارند و کمتر از باقی الکترونها تحت اثر جاذبه هسته اتم هستند. الکترونهای ظرفیت، میزان واکنشپذیری و فعال بودن اتمها را مشخص میکنند و مقدار الکترونگاتیوی اتمها به این الکترونها وابسته است. در این مطلب از مجله فرادرس، بررسی میکنیم الکترون ظرفیت چیست و چه راههایی برای تشخیص آن وجود دارد.

در ابتدای این مطلب بررسی میکنیم الکترون ظرفیت چیست و در چه قسمتی از اتم وجود دارد. سپس تعداد الکترونهای ظرفیت را برای بسیاری از عناصر تعیین کرده و روشی برای تعیین آن ارائه میدهیم. سپس با مفاهیمی مانند پیکربندی الکترونی اتمها، لایهها و زیرلایهها، اعداد کوانتومی اصلی و فرعی و آرایش الکترونی عناصر آشنا میشویم. آرایش الکترونی عناصر نیز یکی از روشهای تعیین الکترون ظرفیت است که در ادامه توضیح داده میشود. در ادامه روابط الکترون ظرفیت را با برخی خواص ماده و واکنش شیمیایی توضیح داده و سطح انرژی الکترونها را در اتمها بررسی میکنیم. در انتها نیز برای تمرین بیشتر، مثالهایی از تعیین الکترون ظرفیت عناصر ارائه کردهایم. با مطالعه این مطلب تا انتها میتوانید با این بخش مهم در ساختار اتمها آشنا شوید.
الکترون ظرفیت چیست؟
الکترون ظرفیت الکترونی است در بیرونیترین لایه اتم قرار گرفته و مسئولیت تشکیل پیوند یا تشکیل یون از اتمها را بر عهده دارد. الکترونهای ظرفیت که بیشترین فاصله را نسبت به هسته اتم دارند، کمترین جاذبه را تجربه میکنند و راحتتر از اتم جدا میشوند یا در پیوندها شرکت میکنند.
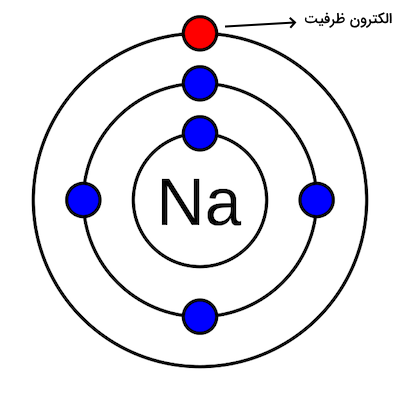
اتمها از سه جزء کوچکتر به نام الکترون، پروتون و نوترون تشکیل شده اند. پروتونها با بار مثبت و نوترونهای خنثی، هسته فشرده و کوچک اتمها را تشکیل میدهند. الکترونها در فضاهایی ابری به دور هسته اتم میچرخند و بار منفی دارند. بار مثبت هسته اتم، الکترونها را به سمت خود میکشد و نگه میدارد. الکترونهای لایههای بیرونیتر کمتر توسط هسته کشیده میشوند و الکترونهای داخلی بیشتر جذب هسته اتم میشوند. از بررسی الکترونهای ظرفیت اتمها میتوان به میزان فعالیت آنها، الکترونگاتیوی آنها و تعداد پیوندهایی که میتوانند تشکیل دهند پی برد. برای مثال، به شکل زیر که ساختار اتم سدیم را نشان میدهد، توجه کنید. الکترون ظرفیت سدیم با رنگ قرمز مشخص شده است. این الکترون با رنگ قرمز مشخص شده است و در بیرونیترین لایه الکترونی قرار دارد.
کلمه ظرفیت (والانس) نشاندهنده این واقعیت است که اتم برای تشکیل پیوند با دیگر اتمها از این الکترونها استفاده میکند. ظرفیت الکترون در گذشته برای بیان این موضوع که چند اتم هیدروژن میتوانند به اتم از طریق این الکترونها متصل شوند، استفاده میشد. برای مثال اتم کربن میتواند به ۴ اتم هیدروژن متصل شود و بدین ترتیب ۴ الکترون ظرفیت دارد.
یادگیری ساختار اتم با فرادرس
اتم که کوچکترین ساختار ماده است، خود از اجزای دیگری مانند پروتون، الکترون و نوترون تشکیل شده است. بسیاری از پدیدههایی که در زندگی اتفاق میافتد، به دلیل برهمکنش بین اتمها یا مولکولها هستند و این برهمکنشها نیز وابسیه به الکترونها و پروتونهای ماده هستند. برای درک بهتر این ساختارها باید با مفاهیمی مانند ساختار اتم، آرایش آفبا، آرایش الکترونی فشرده و … آشنا شوید. پیشنهاد میکنیم برای یادگیری بهتر این مفاهیم به مجموعه فیلم آموزش پایه دهم، بخش شیمی مراجعه کنید که با زبانی ساده ولی کاربردی به توضیح این مفاهیم پرداخته است.
همچنین با مراجعه به فیلمهای آموزش فرادرس که لینک آنها در ادامه آورده شده است، به آموزشهای بیشتری درباره الکترون ظرفیت دسترسی داشته باشید.
تعداد الکترون ظرفیت عناصر
به دو روش کلی میتوان فهمید تعداد الکترونهای ظرفیت یک اتم چیست. این دو روش به شرح زیر هستند.
- تعیین تعداد الکترون ظرفیت از روی شماره گروه
- تعیین الکترون ظرفیت از آرایش الکترونی
برای اطلاع از این موضوع که برای هر عنصر تعداد الکترونهای ظرفیت چیست، میتوانیم از جدول تناوبی عناصر استفاده کنیم. در این روش با نگاه کردن به شماره گروهی که عنصر در آن قرار دارد، میتوانیم الکترونهای ظرفیت آن را بیابیم. در مورد برخی از عناصر، شماره گروه تعداد الکترونهای لایه ظرفیت را مشخص میکند. تعداد الکترونهای ظرفیت برخی از عناصر گروههای جدول تناوبی در ادامه توضیح داده شده است.
- عناصر گروه ۱ و ۲: به تعداد شماره گروه، الکترون ظرفیت دارند.
- عناصر گروههای ۱۳ تا ۱۸: به تعداد یکای شماره گروه الکترون ظرفیت دارند.
باید به این نکته توجه داشته باشید که تعداد الکترونهای ظرفیت اتمهای هر گروه از جدول تناوبی، تعداد برابری دارند. همچنین به این نکته توجه کنید که هلیم با اینکه در گروه ۱۸ واقع شده تنها ۲ الکترون ظرفیت دارد. این عنصر تنها از دو الکترون تشکیل شده است.
عناصر فلزات واسطه از این قانون پیروی نمیکنند زیرا لایههای میانی الکترونی آنها نیز توانایی دریافت الکترون یا تشکیل پیوند دارد و میتوانند ظرفیتهای متفاوتی داشته باشند.
برای مثال ، سدیم در گروه اول، ۱ الکترون ظرفیت و کلر در گروه ۱۷، ۷ الکترون ظرفیت دارد. تعداد الکترونهای ظرفیت اتمها را با حرف انگلیسی «n» نمایش میدهند. تعداد الکترونهای والانس یک اتم مشخص میکند که آن اتم در چه واکنشهای شیمیایی شرکت میکند، با چه موادی پیوند برقرار میکند و چه ویژگیهای شیمیایی دارد. تعداد الکترونهای ظرفیت عناصری مانند فلزات واسطه را باید با استفاده از پیکربندی الکترونی آنها بیابیم.
تعیین تعداد الکترون ظرفیت بر اساس شماره گروه
در جدول زیر تعداد الکترونهای ظرفیت عناصر برخی از گروههای جدول تناوبی مشخص شدهاند.
| شماره گروه اتم | تعداد الکترون ظرفیت |
| گروه ۱: فلزات قلیایی | ۱ |
| گروه ۲: فلزات قلیایی خاکی | ۲ |
| گروه ۱۳: گروه برم | ۳ |
| گروه ۱۴: گروه کربن | ۴ |
| گروه ۱۵: گروه نیتروژن | ۵ |
| گروه ۱۶: گروه اکسیژن | ۶ |
| گروه ۱۷: هالوژنها | ۷ |
| گروه ۱۸: گازهای نجیب | ۸ |
پیکربندی الکترونی اتم
حال که آموختیم الکترون ظرفیت چیست، باید نگاهی به پیکربندی الکترونی اتمها داشته باشیم. همانطور که قبلا توضیح دادیم، الکترونها در لایههای ابری در اطراف هسته اتم میچرخند. هریک از این لایههای الکترونی میتواند تعداد مشخصی الکترون را در خود جای دهد. این لایهها میتوانند به اندازه تمامی ظرفیت خود از الکترون پر باشند یا اینکه ظرفیت خالی نیز داشته باشند. پیکربندی الکترونی اتمها با یک نوشتار خاص نمایش داده میشود که از یک قانون برای تمامی اتمها استفاده میکند. در این نوشتار، تمامی الکترونهای موجود در اتم به همراه شماره الکترونهای هر اوربیتال و عدد کوانتومی اصلی و فرعی نمایش داده میشود.
برای یادگیری بیشتر درباره ساختار اتم میتوانید به فیلم آموزشی «اتم چیست» فرادرس که لینک آن در ادمه آورده شده است، مراجعه کنید.
در قسمت قبل اشاره کردیم که برای تشیص الکترونهای ظرفیت فلزات واسطه باید ساختار پیکربندی الکترونی اتمها را بررسی کنیم. لایههای الکترونی از زیرلایههایی تشکیل شده اند که به آنها اوربیتال گفته میشود. هر لایه الکترونی، تعداد اوربیتالهای مشخص دارد. ر اوربیتال نیز تعداد الکترون مشخصی را در خود جای میدهد.

لایههای الکترونی
برای یادگیری اینکه الکترون ظرفیت چیست، ابتدا باید با لایههای الکترونی آشنا شویم. بیشترین تعداد الکترونی که در هر لایه الکترونی جای میگیرد به عدد کوانتیومی اصلی بستگی دارد که با حرف انگلسیس «n» نمایش داده میشود. عدد کوانتومی اصلی میتواند مقادیری مثبت و بیشتر از صفر (۱، ۲، ۳و …) داشته باشد. تعداد الکترونهای موجود در هر لایه با فرمول مشخص میشود. هریک از لایههای الکترونی با حرف و شماره مشخصی شناسایی میشوند. در جدول زیرلایههای الکترونی به همراه شماره و تعداد الکترونهای آنها مشخص شدهاند. تعدادی از لایه الکترونی از تعداد الکترونهای مشخصی تشکیل شده است که مقدار عدد کوانتومی اصلی آنها با یکدیگر برابر است.
| لایه و مقدار عدد کوانتومی اصلی | تعداد الکترونهای لایه الکترونی |
| n=۱ ، لایه اول | ۲ |
| n= ۲، لایه دوم | ۸ |
| n=۳، لایه سوم | ۱۶ |
| n=۴، لایه چهارم | ۳۲ |
عدد کوانتومی اصلی مقدار فاصله بین الکترون و هسته اتم را مشخص میکند. . هرچه مقدار عدد کوانتومی اصلی بیشتر باشد، الکترونها فاصله بیشتری از هسته اتم دارند. در صورت برابر بودن عدد کوانتومی اصلی الکترونها درمییابیم که آنها فاصله برابری تا هسته اتم دارند.
زیرلایههای اتمها
زیرلایه الکترونی از تعداد الکترونهایی تشکیل شده است که عدد کوانتومی فرعی برابری دارند. اعداد کوانتومی فرعی با حرف انگلیسی «l» نمایش داده میشوند و مقادیری از ۱ تا ۴ را دارند. هر یک از این مقادیر اوربیتالهایی مشخص را نشان میدهد. عدد کوانتومی فرعی ۰ نشان دهنده اوربیتال «s»، عدد کوانتومی فرعی ۱ نشان دهنده اوربیتال «p»، عدد کوانتومی ۲ نشاندهنده اوربیتال «d»، و عدد کوانتومی ۳ نشاندهنده اوربیتال «d» است. هریک از این اوربیتالها تعداد مشخصی الکترون را در خود جای میدهند و انرژی مخصوص به خود را دارند. الکترونهای اتمها به ترتیب از کمترین سطح انرژی این اوربیتالها را پر میکنند.
بیشترین تعداد الکرتونی که میتواند در یک زیرلایه قرار بگیرد، عدد است..
- لایه الکترونی s یک زیرلایه دارد که ۲ الکترون را در خود جای میدهد.
- لایه الکترونی p سه زیرلایه دارد که ۶ الکترون را در خود جای میدهد.
- لایه الکترونی d پنج زیرلایه درارد که ۱۰ الکترون را در خود جای میدهد.
- لایه الکترونی f هفت زیرلایه دارد که ۱۴ الکترون را در خود جای میدهد.
هر ردیف جدول تناوبی میزان انرژی مربوط به خود را دارند. اوربیتالهای p در ردیف دوم جدول تناوبی پر شده، اوربیتالهای d در ردیف چهارم و اوربیتالهای f در لانتانیدها و اکتنیدها شروع به پرشدن میکنند. برای مثال، زیرلایه ۳d مربوط به لایه سوم الکترونی و زیرلایه d است. بیشترین تعداد الکترونی که میتواند در لایهها و زیرلایهها قرار بگیرد از اصل طرد پائولی پیروی میکند. این قانون بیان میکند در هر اوربیتال تنها دو الکترون با اسپینهای متفاوت (چرخشهای متفاوت) میتواند وجود داشته باشد.
آرایش الکترونی اتمها
برای اینکه بدانیم الکترون ظرفیت چیست، ابتدا باید با آرایش الکترونی آشنا شویم. همانطور که قبلا توضیح داده شد، لایههای الکترونی هر یک سطوح انرژی متفاوتی دارند و هر یک از زیرلایههایی تشکیل شدهاند و زیرلایهها نیز انرژیهای متفاوتی دارند. الکترونهای هر اتم به ترتیب از کمترین عدد کوانتومی اصلی، اوربیتالها و زیرلایهها را پر میکنند. آخرین لایه الکترونی، لایه ظرفیت است و الکترونهای ظرفیت در این لایه قرار دارند.
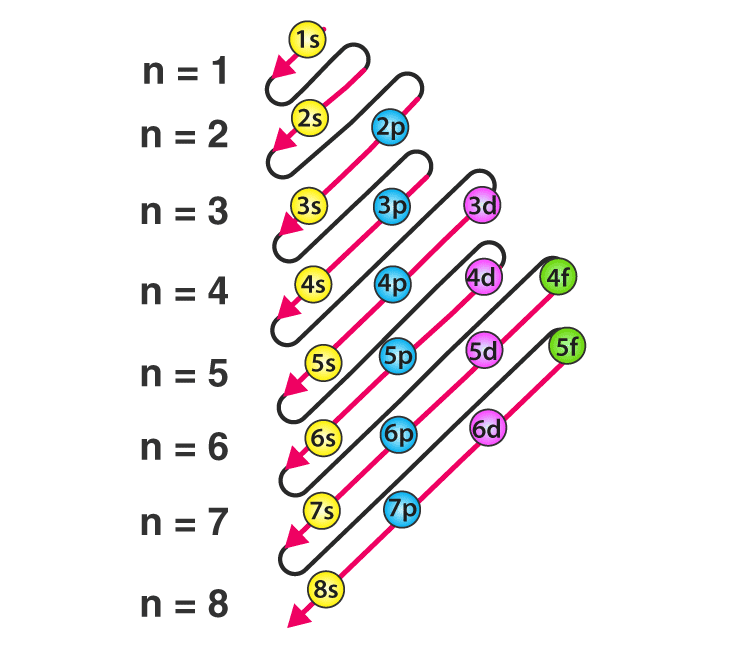
ترتیب پر شدن لایهها و زیرلایهها در تمامی اتمها به شکل زیر است.
الکترونها در هر اتم به ترتیب از چپ به راست لایههای الکترونی و زیرلایهها را اشغال میکنند. در واقع این ترتیب قرارگیری بر اساس سطح انرژی زیرلایهها و لایهها است. الکترونها تمایل دارند که ابتدا لایهها و زیرلایهها با انرژی کمتر را پر کنند. این ترتیب قرارگیری الکترونها در این لایهها اصل آفبا نام دارد و در مورد بیشتر اتمها صدق میکند.
تصویر زیر شکل پر شدن زیرلایههای الکترونی را نشان میدهد. در این شکل، به جهت فلشها دقت کنید.
باید توجه داشته باشید که ممکن است به استثناهایی از اصل آفبا بر بخورید. برای مثال کروم و مس از این اصل پیروی نمیکنند. این استثناها میتواند با پایداری اوربیتالهای نیمهپر توجیه شود.
آرایش الکترونی فشرده
همچنین روش دیگری برای نمایش دادن آرایش الکترونی عناصر به کار میرود که به آن آرایش الکترونی فشرده گفته میشود. در این روش، آن قسمتی از آرایش الکترونی عنصر که مشابه آرایش الکترونی گاز نجیب دوره قبل آن است، با علامت نماد شیمیایی گاز نجیب در براکت و سپس باقی آرایش الکترونی نوشته میشود. پس در نوشتن آرایش الکترونی فشرده عناصر باید به ترتیب زیر عمل کنیم.
- ابتدا آرایش الکترونی عنصر به شکل کامل نوشته میشود.
- قسمتی از آرایش الکترونی که مشابه آرایش الکترونی گاز نجیب دوره قبل عنصر است، داخل براکت و با نماد شیمیایی عنصر گاز نجیب نوشته میشود.
- باقی آرایش الکترونی عنصر، پس از براکت نوشته میشود.
برای درک بهتر آرایش الکترونی فشرده به مثالهای زیر توجه کنید.
- آرایش الکترونی فشرده اتم وانادیوم:
- آرایش الکترونی فشرده اتم کلسیم:
- آرایش الکترونی فشرده اتم آهن:
فرم الکترون نقطه
فرم الکترون نقطه عناصر، ساختاری نمایشی است که در آن الکترونهای ظرفیت عناصر با نقطههایی در اطراف نماد شیمیایی آنها نشان داده میشود. به این روش نمایش، ساختار لوییس نیز گفته میشود. این روش نمایش برای بررسی پیوندهایی که عناصر تشکیل میدهند بسیار مفید است. به دلیل اهمیت الکترونهای ظرفیت اتمها، روش نمایش خاصی برای آنها تعیین شده است. این ساختار که نمایش الکترون- نقطه نام دارد، نماد اتم و الکترونهای لایه ظرفیت آنها را نمایش میدهد.
در این ساختار، الکترونهای ظرفیت به صورت جفت نقطههایی در ۴ طرف اتم نمایش داده میشود. برای مثال به ساختار الکترون نقطه اتمهای لیتیوم، اکسیژن و کریپتون دقت کنید.
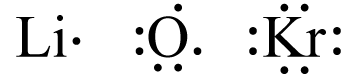
هیچ اتمی نمیتواند بیشتر از تعداد ۸ الکترون والانس در ساختار الکترون نقطه خود داشته باشد. تعداد الکترونهای ظرفیت در هرردیف جدول از بالا به پایین افزایش مییابد.
رسم ساختار الکترون نقطه
برای رسم ساختار الکترون نقطه، باید نقاط نشاندهنده الکترونهای ظرفیت اتم را با قوانین خاصی در ۴ طرف آن جایگذاری کنیم. برای درک بهتر رسم ساختار الکترون نقطه، به رسم این ساختار برای اتم گوگرد توجه کنید.
آرایش الکترونی اتم گوگرد به شکل است. این اتم در آخرین لایه الکترونی خود ۶ الکترون دارد. پس تعداد الکترونهای ظرفیت گوگرد برابر با ۶ است. برای رسم ساختار الکترون نقطه این اتم، به روش زیر عمل میکنیم.
ابتدا اولین الکترون را در یک طرف نماد شیمیایی این عنصر قرار میدهیم. این الکترون میتواند در هریک از ۴ طرف نماد گوگرد، به شکل زیر جای بگیرد.
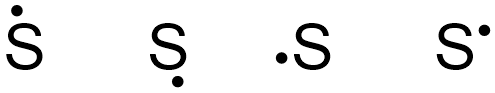
در رسم باقی الکترونهای ظرفیت اتم گوگرد در ساختار الکترون نقطه این عنصر، باید توجه داشته باشیم که ابتدا الکترونها باید هر ۴ وجه نام نماد شیمیایی عنصر را پر کنند و سپس جفت شوند. برای مثال در رسم الکترون دوم گوگرد، نمایشهای صحیح و ناصحیح به شکل زیر خواهند بود.

همانطور که گفته شد، تا پر شدن هر ۴ طرف نماد عنصر، هیچ دو الکترونی نباید به شکل جفت نوشته شوند. پس از رسم الکترونهای سوم و چهارم، ساختار الکترون نقطه این اتم به شکل زیر تبدیل میشود.
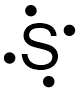
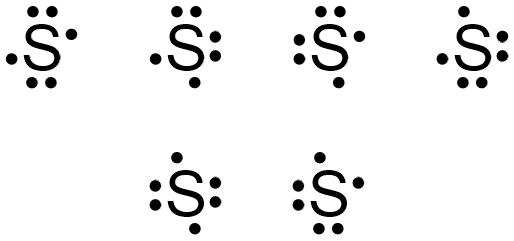
الکترونهای پنجم و ششم ظرفیت این اتم میتوانند در هر سمتی از این نماد قرار بگیرند و با هر الکترونی جفت شوند. باید به این نکته توجه داشته باشید که در هر سمت اتم نهایتا یک جفت الکترون میتواند وجود داشته باشند و الکترونها به فرمهای سهتایی یا بیشتر نمیتوانند در یک سمت وجود داشته باشند. در نهایت فرم نهایی ساختار الکترون نقطه اتم گوگرد به یکی از شکلهای زیر نوشته میشود.
مثال رسم آرایش الکترون نقطه
برای تمرین بیشتر، با توجه به آرایش الکترونی عناصر زیر، آرایش الکترون نقطه آنها را رسم کنید.
مثال ۱
آرایش الکترون نقطه اتم نیتروژن
پاسخ
آرایش الکترونی این عنصر به شکل زیر است.
با توجه به ۵ الکترون ظرفیت این عنصر، آرایش الکترون نقطه آن میتواند فرمهای زیر را داشته باشد.

مثال ۲
آرایش الکترون نقطه اتم نئون
پاسخ
آرایش الکترونی این عنصر به شکل زیر است.
با توجه به ۸ الکترون ظرفیت این عنصر، آرایش الکترون نقطه آن به شکل زیر رسم میشود.

مثال ۳
آرایش الکترون نقطه اتم کلسیم
پاسخ
آرایش الکترونی این عنصر به شکل زیر است.
با توجه به دو الکترون ظرفیت این عنصر، آرایش الکترون نقطه این اتم میتواند به یکی از فرمهای زیر رسم شود.
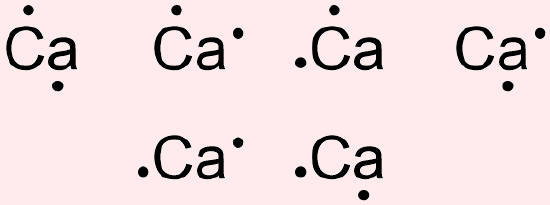
مثال آرایش الکترونی و الکترون ظرفیت
برای درک بهتر آرایش الکترونی و این مفهوم که الکترون ظرفیت چیست، به مثالهای زیر توجه کنید.
هیدروژن
عدد اتمی هیدروژن برابر با ۱ است. این اتم از یک الکترون تشکیل شده است. این الکترون لایه و زیرلایه اول را پر میکند.
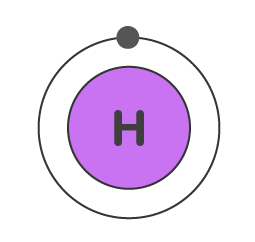
آرایش الکترونی هیدروژن به شکل زیر خواهد بود.
اکسیژن
عدد اتمی اکسیژن برابر با ۸ است و و از ۸ الکترون تشکیل شده است. این الکترونها به ترتیب لایهها و زیرلایهها را در لایه اول و دوم پر میکنند. لایه دوم این اتم، لایه ظرفیت آن میشود.
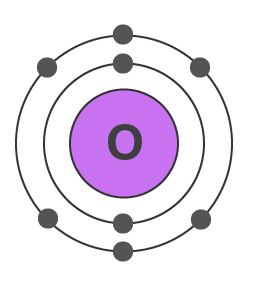
آرایش الکترونی اکسیژن به شکل زیر نوشته میشود. زیرلایهها و لایههای الکترونی به ترتیب زیر در این اتم پر میشوند.
همانطور که با توجه به شکل و آرایش الکترونی این اتم مشاهده میکنید، لایه دوم، لایه ظرفیت اکسیژن خواهد بود که دارای ۶ الکترون ظرفیت است. ساختار الکترون نقطه این اتم به شکل زیر است. این اتم برای رسیدن به اکتت باید ۲ الکترون دریافت کند.

کلر
اتم کلر عدد اتمی برابر با ۱۷ دارد و از ۱۷ الکترون تشکیل شده است. این الکترونها به ترتیب لایههای اول، دوم و سوم را اشغال میکنند.
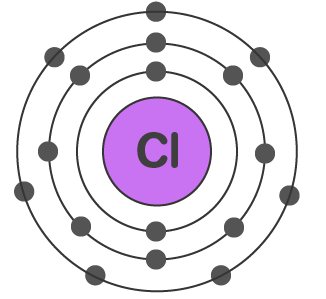
اتم کلر از ۱۷ الکترون تشکیل شده است که به ترتیب زیرلایهها و زیرلایهها را پر میکنند.
همانطور که در شکل و آرایش الکترونی این اتم مشاهده میکنید، لایه سوم این اتم، لایه ظرفیت آن است که از ۷ الکترون ظرفیت تشکیل شده است. شکل زیر، نمایش الکترون نقطه این اتم است. اتم کلر برای رسیدن به اکتت باید یک الکترون دریافت کند.

قاعده اکتت
هشتایی شدن اکترونهای ظرفیت اتمها به وسیله تشکیل یون یا پیوند را قاعده اکتت میگویند. اتمها تمایل دارند که به پایدارترین سطح انرژی خود برسند. این پایداری به وسیله پر بودن تمامی اوربیتالهای ظرفیت آنها انجام میشود. برای مثال کربنی که دارای ۴ پیوند است کربنی پایدار است. برای بسیاری از اتمها اولین لایه الکترونی میتواند ۲ الکترون در خود جای دهد و سایر لایههای الکترونی از جمله لایه ظرفیت، ۸ الکترون را در خود جای میدهند. به همین علت به این قاعده قاعده اکتت گفته میشود که نام آن از عدد ۸ یونانی گرفته شده است.
هیدروژن و هلیم از این قاعده مستثنی هستند. اتم هیدروژن ۱ الکترون و اتم هلیم ۲ الکترون دارند و تنها میتوانند ۲ الکترون درگیر در پیوند داشته باشند. اتم فلزات واسطه نیز میتوانند تعداد بیشتری از ۸ الکترون را در پیوندها استفاده کنند به همیت علت ظرفیتهای متفاوتی دارند.
اتم گازهای نجیب خود ۸ الکترون در لایه ظرفیت خود دارند به همین علت درحالت خنثی در پایدارترین حالت خود قرار دارند و تمایل زیادی به شرکت در واکنشهای شیمیایی را ندارند. در قاعده اکتت، اتمها تمایل دارند به آرایش هشتتایی گاز نجیب برسند تا به وضعیت پایداری برسند. برای مثال برخی از اتمها با تعداد الکترونهای کمتر از ۸ در لایه ظرفیت خود، با ترکیب شدن با سایر اتمها و تشکیل پیوند شیمیایی و به اشتراک گذاشتن الکترونهای ظرفیت، به آرایش ۸ تایی میرسند.
برای مثال اتم سدیم با از دست دادن یک الکترون ظرفیت خود به آرایش ۸ تایی میرسد و پایدار میشود. به همین علت اتم سدیم به فرم یون یک بار مثبت بیشتر از اتم سدیم خنثی در طبیعت وجود دارد.
تعیین الکترون ظرفیت از آرایش الکترونی
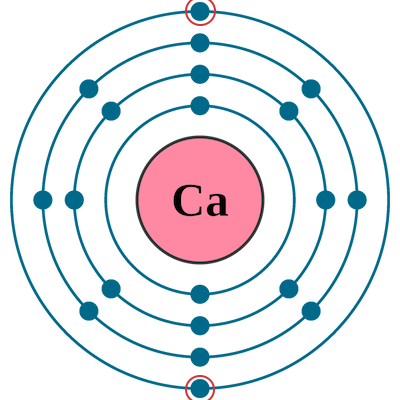
تا اینجا آموختیم آرایش الکترونی و الکترون ظرفیت چیست. با استفاده از آرایش الکترونی عناصر، میتوان به تعداد الکترون ظرفیت آنها پی برد. در این روش باید پس از نوشتن آرایش الکترونی عناصر، تعداد الکترونهای لایه آخر آنها را شمارش کرد. این الکترونها در واقع همان الکترونهای لایه ظرفیت اتم هستند. برای مثال به آرایش الکترونی اتم کلسیم توجه کنید. آرایش الکترونی این عنصر به شکل زیر است.
لایه آخر این اتم لایه چهارم میشود که دو الکترون در زیرلایه s در آن جای گرفته است. شکل لایههای الکترونی این اتم به شکل زیر است.
آرایش الکترونی فلزات واسطه
این روش برای تعیین الکترونهای ظرفیت عناصر واسطه کمی پیچیدهتر است. عناصر فلزات واسطه ممکن است زیرلایههایی در لایههایی پایینتر داشته باشند که در حال پر شدن است. علت متفاوت بودن الکترونهای ظرفیت این عناصر همین پدیده است. در فلزات واسطه، دو زیرلایه s و d بیرونیترین الکترونهای این عناصر هستند و از انرژی بالایی برخوردارند.
اتمهای موجود در هردوی این زیرلایهها میتوانند در واکنشهای شیمیایی، تبدیل یون و تشکیل پیوند شرکت کنند. در این موارد برای پیدا کردن الکترونهای ظرفیت از روی آرایش الکترونی، باید تعداد الکترونهای زیرلایه نیمهپر d و الکترونهای لایه آخر s را شمارش کنیم. در عناصر واسطه معمولا ترتیب پر شدن زیرلایهها به شکل زیر است و تعداد الکترونهای لایه آخر s و الکترونهای زیر لایه d در لایه قبلی آن، به عنوان الکترونهای ظرفیت این عناصر در نظر گرفته میشود.
برای مثال، آرایش الکترونی اتمهای وانادیم و آهن به ترتیب به شکل زیر است.
تعداد الکترونهعای ظرفیت اتم وانادیم ۵ عدد و تعداد الکترونهای ظرفیت اتم آهن ۸ عدد است.
مثال تعیین الکترون ظرفیت از روی آرایش الکترونی
برای درک بهتر این موضوع که رابطه آرایش الکترونی و الکترون ظرفیت چیست، به مثال زیر توجه کنید.
آرایش الکترونی اتمهای نیتروژن، نئون، گوگرد، نیکل و اوسمیم را بنویسید و تعداد الکترونهای ظرفیت آنها را مشخص کنید.
اتم نیتروژن
آرایش الکترونی اتم نیروژن به شکل زیر است.
پاسخ
لایه آخر الکترونی این عنصر، لایه دوم است که ۵ الکترون ظرفیت دارد.
اتم نئون
آرایش الکترونی اتم نئون به شکل زیر است.
پاسخ
لایه آخر الکترونی این عنصر لایه دوم است که ۸ الکترون ظرفیت دارد.
اتم گوگرد
آرایش الکترونی اتم گوگرد به شکل زیر است.
پاسخ
لایه آخر الکترونی این عنصر لایه سوم است که ۶ الکترون دارد.
اتم نیکل
آرایش الکترونی اتم نیکل به شکل زیر است.
پاسخ
دو زیرلایه آخر این عنصر ۳p و ۴s هستند که ۱۰ الکترون ظرفیت دارند.
اتم اوسمیم
آرایش الکترونی اتم اوسمیم به شکل زیر است.
پاسخ
دو زیرلایه آخر این عنصر، ۵d و ۴s هستند که ۸ الکترون ظرفیت را در خود جای دادهاند.
الکترون ظرفیت فلزات واسطه
فلزات واسطه، گروهی چالش برانگیز و جالب در جدول تناوبی عناصر هستند. این فلزات از الگوی خاصی برای آرایش الکترونی پیروی نمیکنند و اغلب بررسی ظرفیت آنها دشوار است. این فلزات به قطعه d جدول تناوبی تعلق دارند. بدین معنا که در این فلزات زیرلایه d در لایههای مختلف الکترونی در حال پر شدن است. بسیاری از فلزات واسطه نمیتوانند با از دست دادن الکترون به آرایش هشتتایی اکتت و آرایش گازهای نجیب برسند.
همچنین، بسیاری از فلزات واسطه میتوانند یونهای مختلف با مقدار بارهای متفاوت تشکیل دهند. برای مثال فلز آهن میتواند ۲ تا ۳ الکترون از لایههای آخر خود از دست داده و یونهای آهن ۲ یا آهن ۳ بار مثبت را تشکیل دهد. آرایش الکترونی این اتم و روش تولید یونهای آن به شکل زیر است.
بنابر اصل آفبا، الکترونها ابتدا زیرلایههای 4s و سپس زیرلایههای 3d را پر میکنند. اما الکترونهای لایه s همواره اولین الکترونهایی هستند که میتوانند از اتم جدا شده یا در تشکیل پیوندهای شیمیایی شرکت کنند. به دلیل این که بیشتر اتمهای فلزات واسطه ۲ الکترون ظرفیت دارند، بار ۲+ یکی از رایجترین بار یونهای فلزات واسطه است.
الگوی آرایش الکترونی فلزات واسطه
وجود یک لایه نیمهپر همواره پایدارتر از وجود زیرلایهها با تعداد الکترونهای دیگر است. بری مثال در مورد آهن زیرلایه d که ۵ الکترون در خود جای داده است، نسبتا پایدار است. به همین علت است که این عنصر میتواند الکترونی از لایه d از دست بدهد و یون سه بار مثبت آهن را تشکیل دهد. بسیاری از فلزات واسطه، تعداد کمی الکترون در لایه d دارند و با از دست دادن آنها میتوانند به آرایش گاز نجیب برسند. برای مثال به آرایش الکترونی اتم اسکاندیوم توجه کنید.
برخی دیگر از فلزات واسطه، زیرلایه d با آرایش پر با ۱۰ الکترون دارند و با از دست دادن الکترونهای لایه s بعدی، میتوانند یونهایی با بارهای متفاوت ایجاد کنند. برای مثال به آرایش الکترون اتمهای مس و روی دقت کنید.
تصویر زیر نشان دهنده انتهای آرایش الکترونی ردیف اول فلزات واسطه و یونهایی است که تشکیل میدهند.
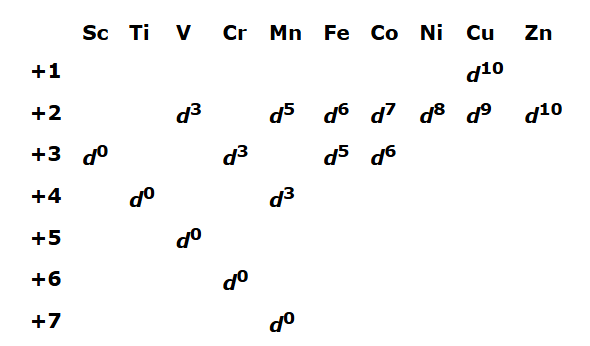
هنگام نوشتن آرایش الکترونی فلزات واسطه باید دقت داشته باشیم، برخی از این اتمها تمایل دارند، زیرلایه d پر با ۱۰ الکترون یا نیمهپر با ۵ الکترون داشته باشند. برای مثال به آرایش الکترونی اتمهای زیر توجه کنید.
| نام عنصر | آٰرایش الکترونی |
| کروم | |
| مس | |
| مولیبدن | |
| نقره |
همانطور که عناصر گروههای s و p جدول تناوبی تمایل داشتند به آرایش ۸ تایی برسند، اتمهای فلزات واسطه (گروه d) تمایل دارند به آرایش ۱۸ تایی برسند که درواقع تعداد الکترونهای زیرلایههای s و p و d است.
الکترون ظرفیت لانتانیدها و اکتنیدها
لانتانیدها و اکتنیدها واقع شده در دوره ۶ و ۷ جدول تناوبی، دارای زیرلایه f در حال پر شدن هستند. نوشتن ساختار الکترونی این اتمها مانند فلزات واسطه است با این تفاوت که طبق اصل آفبا در دوره ششم و هفتم، ابتدا زیرلایه f و سپس زیرلایه d پر میشود. ترتیب پر شدن این زیرلایهها از قاعده زیر پیروی میکند.
در سری لانتانیدها، الکترونهای زیرلایه 5f و در اکتنیدها، الکترونهای زیرلایه 6f پر میشوند. برای مثال، به شکل آرایش الکترونی اتمهای سریم و پلوتونیوم توجه کنید.
با توجه به آرایش الکترونی این اتمها، تعداد الکترون ظرفیت سریم ۴ عدد و تعداد الکترون ظرفیت پلوتونیوم، ۸ عدد است.
مثال
آرایش الکترونی دو اتم نئودیوم و اورانیوم را نوشته و تعداد الکترونهای ظرفیت آنها را مشخص کنید.
پاسخ
آرایش الکترونی این عناصر به شکل زیر است.
با توجه به آرایش الکترونی این عناصر، تعداد الکترون ظرفیت نئودیوم، ۶ و تعداد الکترون ظرفیت اورانیوم، ۶ عدد است.
الکترون ظرفیت و پیوند شیمیایی
تا اینجا اموختیم الکترون ظرفیت چیست و چگونه تعیین میشود. حال میخواهیم بدانیم رابطه پیوند شیمیایی و الکترون ظرفیت چیست. در هر دو نوع پیوند شیمیایی یونی و کوالانسی، الکترونهای والانس هستند که وظیفه شرکت در پیوند را بر عهده دارند. در یک پیوند کووالانسی ساده، معمولا هر دو اتم درگیر در پیوند، یکی از الکترونهای ظرفیت خود را به اشتراک میگذارند. برای مثال به پیوند بین دو اتم کربن در مولکول اتان توجه کنید.
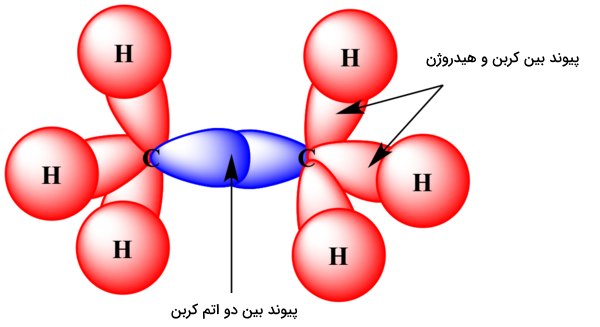
یک پیوند بین اتمهای کربن با اشتراک دو الکترون ظرفیت از اتمهای کربن تشکیل شده است.
در پیوندهای یونی، الکترونهای ظرفیت، به شکلی کامل بین اتمهای مختلف انتقال داده میشود. این نوع پیوند، پیوندی است که دو اتم با بارهای مخالف یکدیگر راجذب کرده و مولکولی جدید تولید میکند. در این نوع انتقال الکترون، یک الکترون ظرفیت از یک اتم به طور کامل جدا شده و به اتم دیگر منتقل میشود. اتمی که الکترون را از دست داده است به یون مثبت (کاتیون) و اتمی که الکترون را دریافت کرده است به یون منفی (آنیون) تبدیل میشود. آنیونها و کاتیونهای مختلف در مولکولها و اتمها میتوانند با یکدیگر پیوند داده و این الکترون اضافی را با اتم دیگر به اشتراک بگذارند.
الکترون ظرفیت و واکنش شیمیایی
در قسمت قبل آموختیم رابطه پیوند شیمیایی با الکترون ظرفیت چیست. حال می خواهیم بررسی کنیم رابطه موجود بین واکنشهای شیمیایی و الکترون ظرفیت چیست. در واکنشهای شیمیایی، الکترونهای ظرفیت میتوانند از لایه ظرفیت اتم جدا شوند. این پدیده باعث به وجود آمدن یونها و پیوندهای یونی میشود. یونهای مثبت با دریافت الکترون و یونهای منفی با از دست دادن این الکترونها پیوند شیمیایی تشکیل داده و در واکنشهای شیمیایی شرکت میکنند. گازهای نجیب، اتمهایی هستند ک لایه ظرفیات آنها از الکترونها پر شده است و اوربیتال خالی در لایه ظرفیت آنها وجود ندارد. به همین علت تمایلی به از دست دادن یا دریافت الکترون ندارد به همین علت، این اتمها تمایل زیادی به شرکت در واکنشهای شیمیایی ندارند.

الکترون ظرفیت و واکنش پذیری
یکی از عوامل ایجاد پیوند و انجام واکنش شیمیایی، واکنشپذیری اتمها است. در این مرحله بررسی میکنیم رابطه بین واکنشپذیری و الکترون ظرفیت چیست. محل، تعداد و نوع الکترونهای ظرفیت نقشی مهم در واکنشپذیری اتمها دارند. همانطور که در قسمتهای قبل توضیح داده شد، الکترونهای ظرفیت از اتمها جدا میشوند و یونها را به وجود میآورند. این یونها با ترکیب با یکدیگر، ترکیبات یونی پایداری را به فرم کریستالی پدید میآورند. برای مثال، نمک طعام از ترکیب دو یون سدیم و کلر تشکیل میشود. تشکیل این یونها را با توجه به آرایش الکترونی آنها در زیر مشاهده میکنید.
همچنین الکترونهای ظرفیت میتوانند در واکنشناپذیری اتمها نیز نقش داشته باشند. برای مثال، گازهای نجیب آرایش الکترونی پایداری با پر بودن اوربیتالهای s و p دارند. این اتمها خود آرایشی ۸ تایی دارند و به سختی این الکترونها را از دست داده و یا به اشتراک میگذارند. برای مثال، آرایش الکترونی اتمهای آرگون و نئون به شکل زیر است.
عناصری با آرایش الکترونی پر و نیمهپر، از لحاظ واکنشپذیری خنثیتر و پایدارتر هستند. اگر آرایش الکترونی این عناصر یک یا دو الکترون کمتر یا بیشتر از آرایش الکترونی گازهای نجیب داشته باشد، به شدت واکنش پذیر میشوند. به همین علت است که واکنشپذیری فلزات قلیایی و قلیایی خاکی و عناصری مانند گروه اکسیژن و هالوژنها بسیار بالا است.
الکترون ظرفیت و ساختار الکترونی عناصر گروههای مختلف نقشی اساسی در تعیین خواص آنها دارد. برای آشنایی بیشتر با این خواص پیشنهاد میکنیم مطلب قانون دورهای عنصرها مجله فرادرس را مطالعه کنید که با زبانی ساده و به شکل کامل این خواص و ارتباط آنها با الکترون ظرفیت را بیان میکند.
البته واکنشپذیری تنها به تعداد الکترونها مربوط نیست و عوامل دیگری نیز بر آن اثر میگذارد. برای مثال اثر شعاع اتمی باعث میشود برخی از الکترونها جاذبه کمتری را نسبت به هسته تجربه کنند و راحتتر آزاد شوند و این پدیده باعث افزایش واکنشپذیری آنها خواهد شد. میزان واکنشپذیری مواد با کمیتی به نام الکترونگاتیوی سنجیده میشود.
الکترون ظرفیت و جدول تناوبی
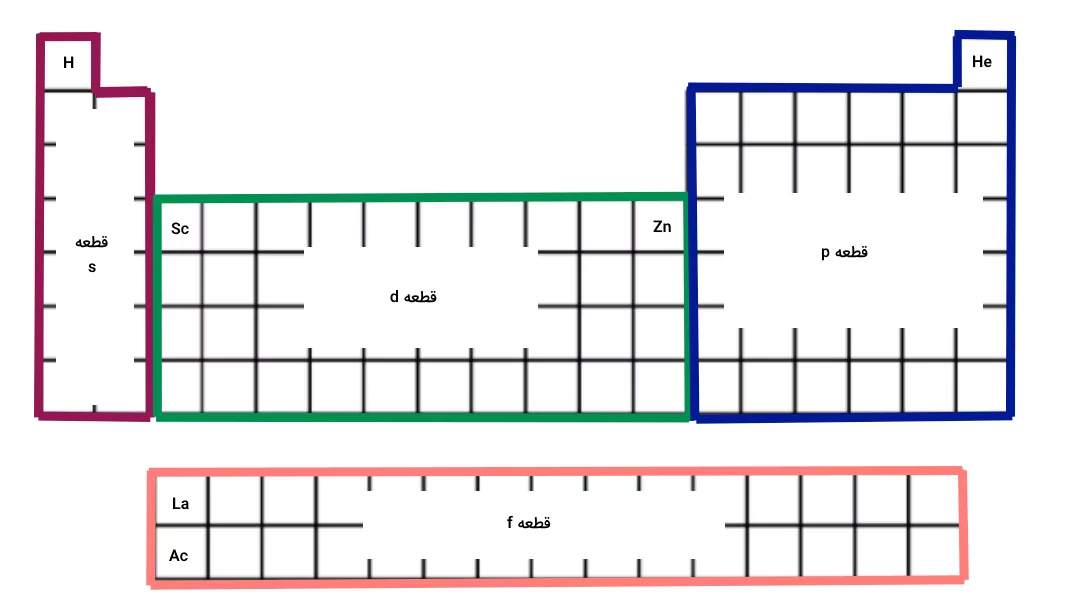
همانطور که قبلا اشاره کردیم در هر گروه تعداد الکترون ظرفیت عناصر با یکدیگر برابر است. حال میخواهیم بررسی کنیم الگوی تغییر در جدول تناوبی برای الکترون ظرفیت چیست. در هر ردیف از چپ به راست الکترونها افزوده شده و لایهها و زیرلایههای بالاتر را پر میکنند. اگر دقت کرده باشید، هر قسمت از جدول تناوبی از الگوی خاصی در پر کردن زیرلایهها پیروی میکند. این الگوها به شکل زیر هستند و هریک از این الگوها قسمتی از جدول تناوبی را تشیکل میدهند که با نام خاصی شناخته میشوند.
- فلزات قلیایی و قلیایی خاکی (گروه ۱ و ۲) الکترونهای ظرفیت در لایه s دارند. به این دو گروه اتمها قطعه s یا «s-block» گفته میشود.
- الکترونهای ظرفیت در فلزات واسطه، زیرلایه d را پر میکنند. به این اتمها در جدول تناوبی، قطعه d یا «d-block» گفته میشود.
- اللکترونهای ظرفیت در گروههای ۱۳ تا ۱۸، زیرلایه p را پر میکنند. به این گروه از اتمها، قطعه p یا «p-block» گفته میشود.
- الکترونهای ظرفیت لانتانیدها و اکتنیدها، زیرلایه f را پر میکنند و به این اتمها قطعه f یا «f-block» گفته میشود.
تصویر زیر نمایانگر این تقسیمبندی جدول تناوبی است.
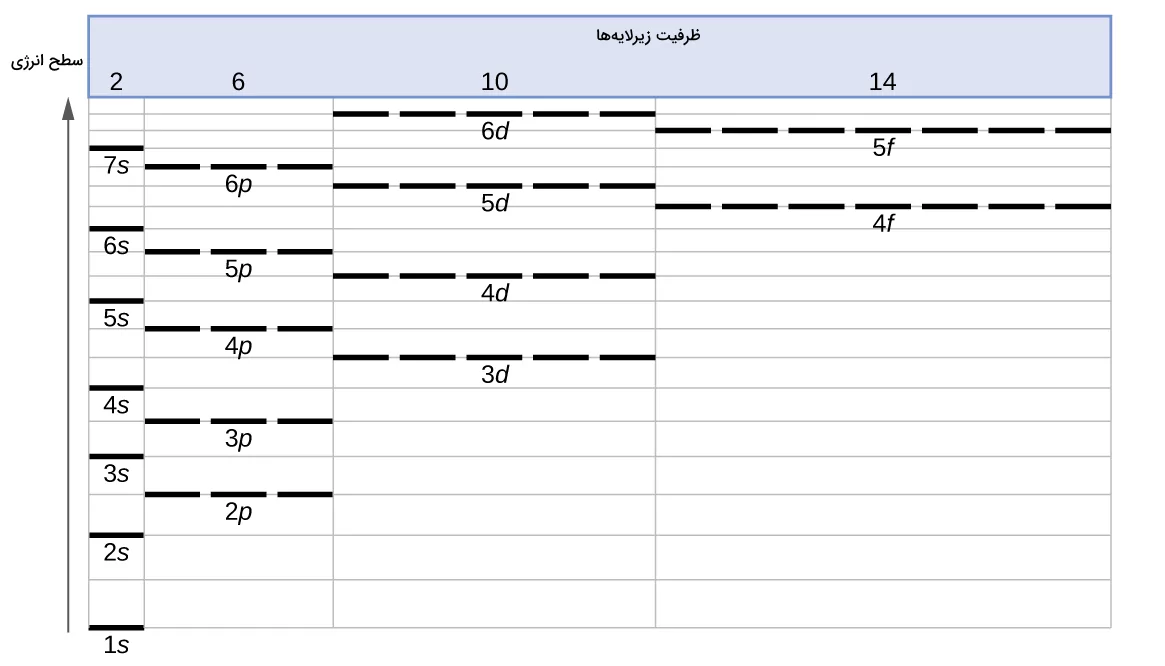
سطح انرژی الکترونها و لایهها
تا اینجا آموختیم الکترون ظرفیت چیست و از چه الگوهایی پیروی میکند. همانطور که قبل تر اشاره شد الکترونها در لایههایی اطراف هسته اتم در حال حرکت هستند. قبلا تصور میشد که الکترونها بدون الگوی مشخصی مانند قطرات باران و در حجمی نامشخص اطراف هسته اتم پراکنده شدهاند. بعدها دانشمند آلمانی، نیلز بور «Niels Bohr» اثبات کرد که این تصور نادرست است.
او در مدل اتمی بور، بیان کرد که الکترونها دارای کمیتهای انرژی کوانتومی (بستهای) هستند. این کمیتها باعث میشود که الکترونها در فواصلی مشخص از هسته اتم قرار بگیرند. این ساختار بیشتر توسط پلهای با فواصل مشخص تصور میشود. فواصل مشخصی که الکترونها در آنها قرار میگیرند با عنوان سطح انرژی شناخته میشوند. هر دوره در جدول تناوبی، سطح انرژی مشخصی دارد. در نتیجه ۷ سطح انرژی مشخص در هر اتم وجود دارد.
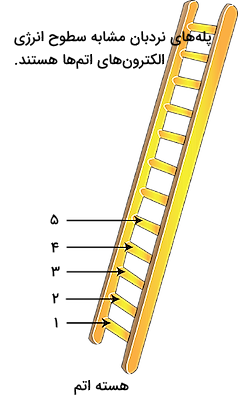
الکترونها میتوانند با دریافت انرژی بین این سطوح انرژی مختلف حرکت کنند و هنگام برگشت به حالت قبلی خود انرژی را به صورت نور آزاد کنند. تشکیل طیفهای نشری یا جذبی اتمها به این شیوه انجام میشود و یکی از مهمترین روشهای شناسایی عناصر، بررسی طیف نشری یا جذبی آنهاست. این طیفها مانند اثر انگشت عناصر هستند و هر عنصر طیف منحصر به فرد خود را دارد.
ترتیب افزایش انری در لایهها و زیرلایههای الکترونی اتمها در تصویر زیر مشخص شده است.
اوربیتالها
جای الکترونهای اطراف هسته میتواند به مقادیر دقیقتری تعمیم داده شود. سطوح انرژی اشاره شده در قسمت قبلی، دارای یک یا تعداد بیشتری اوربیتال است. اوربیتالها مکانهای مشخصی اطراف هسته اتم هستند که الکترونها میتوانند در آن مکانها وجود داشته باشند. چهار نوع کلی اوربیتال وجود دارد که با نامهای s و p و d و f شناخته میشوند.
ویژگی اوربیتال ها
اوربیتالهای نوع s سطوح انرژی با شکل کروی و متقارن هستند و هریک از این اوربیتالها میتوانند دو الکترون را در خود جای دهند. شکل زیر اوربیتالهای s را برای سه سطح انرژی اول تا سوم نشان میدهد.
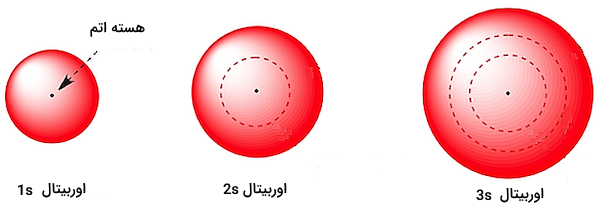
شکل و اندازه این اوربیتالها به گونهای است که اوربیتالهای s بزرگتر میتوانند اوربیتالهای لایهها (سطوح انرژی) پایینتر را در بر بگیرند.
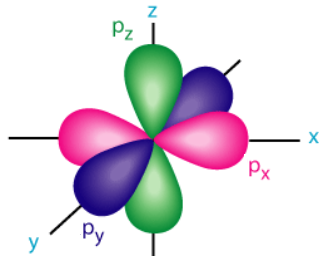
اوربیتالهای p سطوح انرژی دمبلی شکلی هستند که تعداد ۶ الکترون را در خود جای میدهند. هریک از دمبلهای این اوربیتالها در یک بعد مکانی جای میگیرند. شکل اوربیتالهای p در تصویر زیر مشخص شده است.
یادگیری شیمی عمومی با فرادرس
شیمی که یکی از علوم مهم در زندگی با کاربردهای فراوان است، در واقع علم اتمها و عناصر مختلف و برهمکنش آنها با یکدیگر است. این اتمها از اجزای کوچکتری مانند الکترونها و پروتونها و نوترونها تشکیل شدهاند. شناخت اتمها و ساختار و برهمکنش آنها از مهمترین مباحث پایه برای درک مسائل پیچیدهتر شیمی و واکنشهای شیمیایی است. پیشنهاد میکنیم برای درک بهتر این مسائل و مفاهیم به مجموعه آموزش دروس شیمی از دانشگاهی تا کاربردی فرادرس مراجعه کنید که با زبانی ساده ولی کاربردی به توضیح مفاهیم مربوط به اتمها و برهمکنش آنها میپردازد.
همچنین با مراجعه به فیلمهای آموزش فرادرس که لینک آنها در ادامه اورده شده است، میتوانید به آموزشهای بیشتری درباره شیمی دسترسی داشته باشید.
مثال الکترون ظرفیت
تا اینجا آموختیم الکترون ظرفیت چیست و چگونه تعیین میشود. در ادامه این مطلب از مجله فرادرس، با حل تمرینها و مثالهای تعیین الکترون ظرفیت عناصر، این مبحث را به خوبی بیاموزید. برای هریک از عناصر زیر، آرایش الکترونی باز و فشرده را نوشته، سپس تعیین کنید که چه تعداد الکترون ظرفیت دارند. در نهایت آرایش الکترون نقطه این عناصر را رسم کنید.
مثال ۱
تعداد الکترون ظرفیت عنصر پتاسیم چیست؟
پاسخ
آرایش الکترونی عنصر پتاسیم به شکل زیر است:
یا
با توجه به آرایش الکترونی این عنصر، پتاسیم ۱ الکترون ظرفیت دارد و شکل الکترون نقطه آن به شکل زیر است.

مثال ۲
تعداد الکترون ظرفیت عنصر منیزیم چیست؟
پاسخ
آرایش الکترونی عنصر منیزیم به شکل زیر است.
یا
با توجه به آرایش الکترونی این عنصر، منیزیم ۲ الکترون ظرفیت دارد و آرایش الکترون نقطه آن به شکل زیر است.
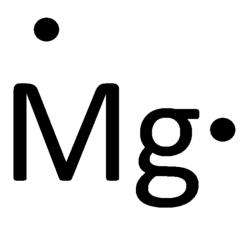
مثال ۳
تعداد الکترون ظرفیت عنصر بور را به دست آورید.
پاسخ
آرایش الکترونی عنصر بور به شکل زیر است.
با توجه به آرایش الکترونی این عنصر، بور ۳ الکترون ظرفیت دارد و آرایش الکترون نقطه آن به شکل زیر است.
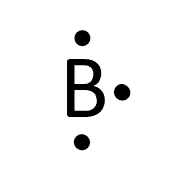
مثال ۴
روش تعیین الکترون ظرفیت عنصر آلومینیوم چیست؟
پاسخ
آرایش الکترونی عنصر آلومینیوم به شکل زیر است.
یا
با توجه به آرایش الکترونی این عنصر، آلومینیوم ۳ الکترون ظرفیت دارد و آرایش الکترون نقطه آن به شکل زیر خواهد بود.

مثال ۵
روش تعیین الکترون ظرفیت عنصر کلر چیست؟
پاسخ
آرایش الکترونی این عنصر به شکل زیر است.
یا
با توجه به آرایش الکترون نقطه این اتم، کلر ۷ الکترون ظرفیت دارد و آرایش الکترون نقطه آن به شکل زیر خواهد بود.

مثال ۶
بررسی کنید تعداد الکترون ظرفیت عنصر کبالت چیست؟
پاسخ
آرایش الکترونی این عنصر به شکل زیر است.
یا
با توجه به آرایش الکترونی این عنصر، کبالت ۹ الکترون ظرفیت دارد و با از دست دادن دو یا سه الکترون میتواند یونهای دو و سه بار مثبت تولید کند.
آرایش الکترون نقطه برای این عنصر و باقی عناصر واسطه به طور معمول رسم نمیشود.
مثال ۷
تعداد الکترونهای ظرفیت عناصر روی، مس و کروم را به دست آورید.
پاسخ
آرایش الکترونی این عناصر به شکل زیر است.
یا
پس تعداد الکترون ظرفیت روی برابر با ۱۲ عدد است.
یا
پس تعداد الکترون ظرفیت مس برابر با ۱۱ عدد است.
یا
پس تعداد الکترون ظرفیت اتم کروم برابر با ۶ عدد است.
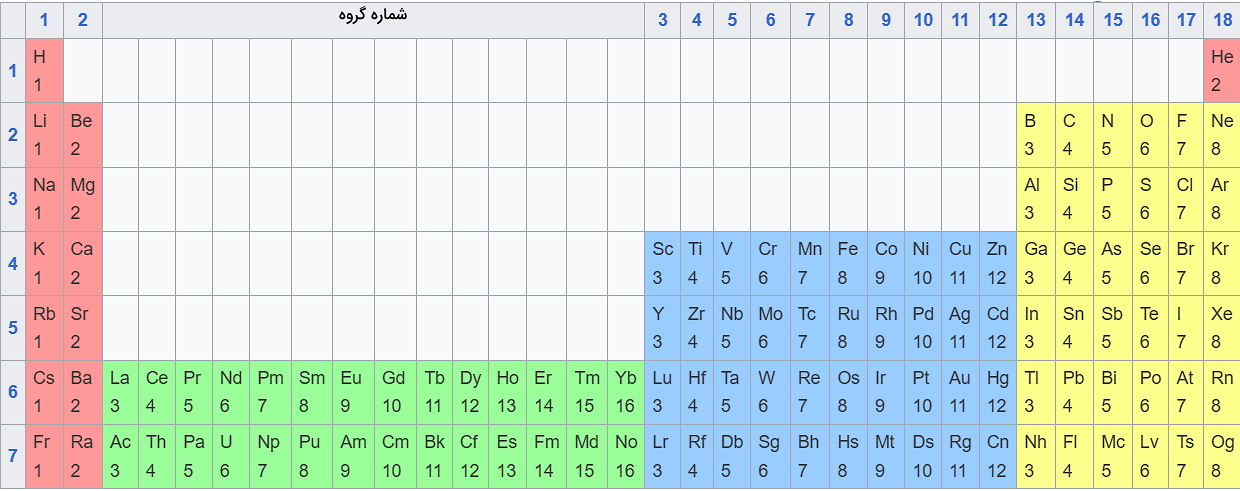
جدول تعداد الکترونهای ظرفیت تمام عناصر
در تصویر زیر، تعداد الکترونهای ظرفیت تمامی عناصر جدول تناوبی مشخص شده است.
جمعبندی
در این مطلب آموخیتم الکترون ظرفیت چیست و چگونه تعیین میشود.الکترون ظرفیت درواقع به الکترونهای لایههای آخر اتم در مدل اتمی بور گفته میشود. این الکترونها در هر گروه از جدول تناوبی برای عناصر برابر هستند و مسئولیت شرکت در واکنشهای شیمیایی و تشکیل پیوند را بر عهده دارند. اتمها میتوانند الکترونهای ظرفیت خود را از دست داده و با رسیدن به آرایش گازهای نجیب، یون تولید کنند و پیوند یونی تشکیل دهند. الکترونهای ظرفیت در سطح انرژی مواد و واکنشپذیری آنها نقشی اساسی دارند.
source