فرمول های شیمی دهم از مهمترین مباحث پایه شیمی در دوره متوسطه هستند و یادگیری آنها میتواند به یادگیری مفاهیم پیچیدهتر شیمی پایههای بالاتر و حل مسائل کنکور کمک کند. در کتاب شیمی ۱ پایه دهم، مباحثی مانند ساختار اتم، نماد شیمیایی عناصر و یکای جرم اتمی بیان میشود. همچنین آرایش الکترونی اتم، استوکیومتری واکنش، رفتار گازها، روشهای بیان غلظت و فرمول شیمیایی ترکیبات یونی نیز بررسی میشود. در این مطلب از مجله فرادرس نگاهی کلی به فرمول های شیمی دهم میاندازیم و مباحث مهم مربوط به آنها را به شکلی مختصر و کاربردی توضیح میدهیم.

در ابتدای این مطلب ابتدا فرمول های شیمی دهم فصل اول با موضوع کیهان زادگاه عناصر را در جدولی ارائه میکنیم و سپس به بررسی نکات مهم این فصل مانند جرم اتمی، جرم مولی و آرایشهای الکترونی میپردازیم. در قسمت بعدی این مطلب، نگاهی کلی به فرمول های فصل دوم، رد پای گازها در زندگی، خواهیم داشت و سپس به بررسی مباحث استوکیومتری، رفتار گازها و دیگر مباحث مهم این فصل خواهیم پرداخت. در نهایت فرمول های شیمی دهم فصل سوم با موضوع آب، آهنگ زندگی را بررسی میکنیم و مثالهایی را برای فهم بهتر مباحث غلظت محلولها توضیح خواهیم داد. با مطالعه این مطلب تا انتها، میتوانید این مفاهیم و مسائل مهم را به شکلی خلاصه و کاربردی بیاموزید.
فرمول های شیمی دهم فصل اول
فرمول های شیمی دهم فصل اول در جدول زیر خلاصه شدهاند.
| مبحث مورد نظر | فرمول های شیمی دهم فصل اول |
| محاسبه انرژی تولید شده در واکنشهای هستهای | |
| نماد همگانی اتمها | |
| یکای جرم اتمی | amu = جرم یک دوازدهم اتم کربن-۱۲ |
| جرم اتمی | تعداد پروتون + تعداد نوترون |
| جرم اتمی میانگین | درصد فراوانی ایزوتوپهای عنصر × جرم اتمی ایزوتوپ = |
| عدد آووگادرو | |
| کسر تبدیل متر و سانتیمتر | |
| کسر تبدیل جرم به مول عناصر | جرم مولی عنصر = |
| لایههای اتمی | 1n و 2n و 3n و 4n و 5n و 6n و 7n |
| زیرلایههای اتم | s و p و d و f |
| آرایش الکترونی فشرده | علامت عنصر هالوژن + باقی آرایش الکترونی |
| حداکثر تعداد الکترون در یک سطح انرژی (n) | |
| حداکثر تعداد اوربیتال در یک سطح انرژی (n) | |
| تشخیص ظرفیت اتمهای گروه ۱ و۲ | تعداد الکترونهای ظرفیت = شماره گروه |
| تشخیص ظرفیت اتمهای گروه ۱۲ تا ۱۸ | تعداد الکترونهای ظرفیت = عدد یکان شماره گروه |
| شعاع اتمی کووالانسی | نصف فاصله بین دو هسته اتم |
در ادامه به اختصار به بررسی هریک از این مفاهیم میپردازیم.
محاسبه انرژی تولید شده در واکنشهای هستهای
در علم فیزیک رابطهای به نام معادله جرم – انرژی وجود دارد که توسط فیزیکدان آلمانی آلبرت اینشتین اثبات شده است. طبق این رابطه، انرژی آزاد شده از خورشید به دلیل واکنشهای هستهای با جرم ماده و توان دوم سرعت نور رابطه دارد. فرمول محاسبه این رابطه به شکل زیر است که در آن E میزان انرژی، m جرم ماده و C سرعت نور در خلأ است.
سرعت نور در خلأ برابر با متر بر ثانیه است.
نماد همگانی اتمها
برای نشان دادن هر اتم به شکلی مشخص، نماد همگانی اتمها معرفی شده است. در این نماد همگانی، یک نماد دو حرفی لاتین برای نشان دادن نام عنصر نوشته میشود. عدد اتمی عنصر در پایین و سمت چپ قبل از نام عنصر نوشته میشود. عدد جرمی آن نیز در سمت چپ و بالا قبل از نام عنصر نوشته میشود. این شیوه نمایش در تصویر زیر نشان داده شده است.

عدد اتمی «A» هر عنصر برابر با تعداد پروتونهای آن است. عدد جرمی «Z» هر عنصر برابر با جمع تعداد پروتونها و نوترونهای آن است.
یکای جرم اتمی
یکی از مهمترین فرمول های شیمی دهم یکای جرم اتمی است. یکای جم اتمی «amu» برابر با جرم یک دوازدهم جرم اتم کربن-۱۲ است. جرم اتمها مقدار بسیار کمی دارد و اندازهگیری آن به وسیله دستگاههای پیشرفتهای به نام طیف سنج جرمی انجام میشود.
هرچند اندازهگیری مقدار بسیار پایین جرم اتمها بر حسب گرم محاسبات مربوط به آنها را بسیار سخت و پیچیده میسازد و کاربردی نیست. به همین دلیل، یک واحد اندازهگیری نسبی برای جرم اتمها در نظر گرفته شده است که با نام یکای جرم اتمی «amu» شناخته میشود.
دانشمندان اتم کربن-۱۲ را برای این اندازهگیری و مقایسه انتخاب کردهاند. بدین ترتیب، یک اتم کربن-۱۲ برابر با ۱۲ واحد جرم اتمی جرم دارد. بدین ترتیب یکای واحد جرم اتمی برابر با یک دوازدهم جرم اتم کربن-۱۲ در نظر گرفته میشود. کلمه amu حروف اختصاری برای عبارت انگلیسی «Atomic mass unit» به معنی واحد (یکای) جرم اتمی است. برای مثال یک اتم هلیوم-۴ جرمی برابر با (amu) ۴٫۰۰۲۶ دارد.
عدد جرمی
عدد جرمی اتمها برابر با جمع تعداد پروتونها و نوترونهای اتم است. مطالعات دانشمندان ثابت کرده است که بیشتر جرم اتمها در هسته آنها متمرکز شده است. هسته جرمی کوچک و منسجم از پروتونها و نروترونها است. عدد جرمی اتمها در سمت چپ و بالای نماد عنصر نوشته میشود و با حرف انگلیسی A نشان داده میشود.
A = پروتون + نوترون
جرم اتمی میانگین
جرم اتمی میانگین مجموع ضرب عدد جرمی تمامی ایزوتوپهای آن عنصر در درصد فراوانی آن ایزوتوپها است. عدد جرمی عناصر را میتوان از جدول تناوبی به دست آورد. مقدار عدد جرمی، مقداری تئوری است و در طبیعت اتمها با این جرم یافت نمیشوند. اتمهایی که ایزوتوپهایی مختلف دارند به شکل ترکیبی از ایزوتوپهای آنها وجود دارند. به همین دلیل عبارت جرم اتمی میانگین برای پیشبینی جرم اتمها ارائه شده است. جرم اتمی عناصر میانگین درصد فراوانی ایزوتوپهای آنها در جرم اتمی این ایزوتوپها است. فرمول جرم اتمی میانگین به شکل زیر است.
جرم اتمی میانگین = جرم اتمی میانگین
در این فرمول f درصد فراوانی ایزوتوپ و M جرم اتمی آن است. برای درک بهتر این فرمول شیمی دهم به مثال زیر توجه کنید.
مثال جرم اتمی میانگین
جرم اتمی میانگین عنصر کلر را محاسبه کنید. این عنصر دو ایزوتوپ کلر-۳۵ و کلر-۳۷ با درصد فراوانیهای ۷۵٫۷۷٪ و ۲۴٫۲۳٪ دارد.
پاسخ
جرم اتمی میانگین این عنصر مجموعی از درصد فراوانی ایزوتوپهای آن در جرم اتمی هر ایزوتوپ است.
= جرم اتمی میانگین کلر

عدد آووگادرو
آمدئو آووگادرو، عددی را برای شمارش راحتتر ذرات مواد مانند اتم، مولکول، یون، الکترون و…. بیان کرد. عدد آووگادرو تعداد واحدهای موجود در یک مول از هرنوع مادهای را نشان میدهد. این عدد که برابر با ذره است میتواند به هر ذرهای از ماده مانند الکترون، اتم، مولکول، یون و… اختصاص یابد. به تعداد عدد آووگادرو ذره یک مول گفته میشود. برای مثال در یک مول مولکول آب تعداد مولکول آب وجود دارد.
جرم مولی عنصر
یکی از مهمترین فرمول های شیمی دهم فرمول جرم مولی عناصر است. جرم مولی عناصر بیان میکند هر مول از یک عنصر چند گرم جرم دارد. واحد اندازهگیری جرم مولی گرم بر مول است و با علامت «g/mol» نشان داده میشود. مقدار جرم مولی عناصر با جرم آنها بر اساس واحد یکای جرم اتمی برابر است. برای مثال جرم اتمی عنصر اکسیژن برابر با( amu) ۱۶ است و جرم مولی آن نیز (g/mol) ۱۶ است. به بیان دقیقتر، اگر ۱۶ گرم از اتم اکسیژن داشته باشیم، تعداد اتم اکسیژن خواهیم داشت.
برای درک بهتر مفهوم جرم مولی به مثال زیر توجه کنید.
مثال جرم مولی
مقدار جرم مولی ماسه (سیلیکون دیاکسید) را با فرمول محاسبه کنید.
جرم مولی سیلیکون (سیلیسیم) ۲۸٫۰۸۵ گرم بر مول و جرم مولی اکسیژن ۱۵٫۹۹۹ گرم بر مول است.
پاسخ
میزان جرم مولی این ماده از جمع جرم مولی اتمهای تشکیل دهنده آن به دست میآید. این ماده از یک اتم سیلیکون (سیلیسیم) و دو اتم اکسیژن تشکیل شده است. پس محاسبات آن به شکل زیر خواهد بود.
لایهها و زیرلایههای اتم
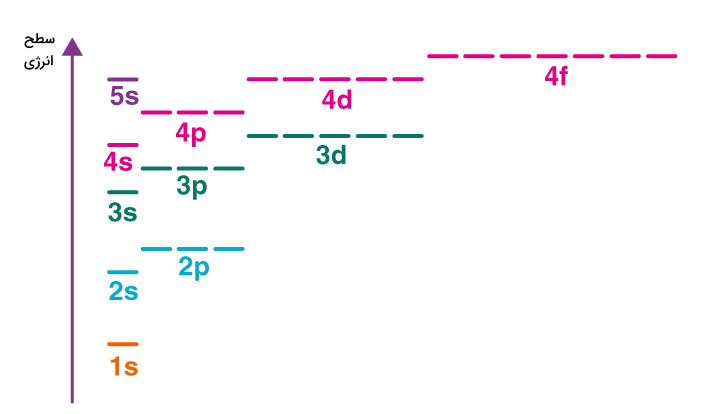
در مدل کوانتومی که دانشمندان برای اتم و الکترونهای آن کشف کردهاند، هسته اتم در مرکز ساختار اتم قرار دارد و الکترونها در لایههای الکترونی اطراف آن میچرخند. در این مدل هر لایه الکترونی انرژی مشخصی دارد و از زیرلایههای مشخصی تشکیل شده است. لایههای اتم با عدد کوانتومی اصلی «n» نمایش داده میشوند و مقادیر ۱ تا ۷ را به خود اختصاص میدهند. زیرلایههای اتم با عدد کوانتومی فرعی «l» نمایش داده میشوند و ۴ مدل s، p، d، و f انواع این زیرلایهها هستند. زیرلایه s، یک اوربیتال الکترونی دارد و دو الکترون در آن جای میگیرند. زیرلایه p، سه اوربیتال دارد و ۶ الکترون در آن جای میگیرند. زیرلایه d، پنج اوربیتال دارد و ۱۰ الکترون در آن جای میگیرند. در نهایت زیرلایه f، هفت اوربیتال دارد و ۱۴ الکترون در آن جای میگیرند.
الکترونها طبق اصل آفبا این زیرلایهها و اروبیتالها را پر میکنند و هر کدام انرژی مخصوص به خود را دارند. آرایش الکترونی عناصر نوشتن ترتیب پر شدن این لایهها برای هر عنصر به همراه تعداد الکترون آنها است. تعداد الکترونهای هر زیرلایه با عدد کوچکی در سمت راست و بالای علامت زیرلایه نمایش داده میشود. الکترونها با حرکت بین لایههای الکترونی انرژی را به صورت نور با طول موجی مشخص آزاد میکنند. ترتیب و سطح انرژی لایهها و زیرلایهها در تصویر زیر مشخص شده است.
مقدار انرژی زیرلایهها به مقادیر عدد کوانتومی اصلی و فرعی بستگی دارد. بدین صورت که اگر مقادیر n+l برای دو زیرلایه برابر شود، ابتدا زیرلایهای که عدد کوانتومی اصلی بزرگتری دارد پر میشود.
ترتیب پر شدن این زیرلایهها بر اساس سطح انرژی آنها به شکل زیر است.
برای مثال آرایش الکترونی اتم کربن با ۶ الکترون به شکل نمایش می دهند.
مثال آرایش الکترونی عناصر
آرایش الکترونی اتمهای نئون، کلر و سدیم را بنویسید.
پاسخ
ارایش الکترونی اتمهای مشخص شده به شکل زیر است.
- نئون:
- کلر:
- سدیم:
آرایش الکترونی فشرده
در نمایش آرایش الکترونی عناصر میتوان قسمتی از زیرلایهها را که مربوط به فلزات نجیب هستند با نوشتن نام عنصر گاز نجیب در براکت و سپس بعد از آن نوشتن باقی آرایش الکترونی مشخص کرد. به این نوع ارایش الکترونی، آرایش الکترونی فشرده گفته میشود. برای مثال آرایش الکترونی فشرده سدیم و کلر به شکل زیر است.
- کلر:
- سدیم:
مثال آرایش الکترونی فشرده
آرایش الکترونی فشرده اتمهای آلومینیوم، کلسیم و زنون را بنویسید.
پاسخ
آرایش الکترونی اتمهای ذکر شده در زیر آورده شده است.
- آلومینیوم:
- کلسیم:
- زنون:
ظرفیت اتمها و الکترونهای والانس
یکی دیگر از مباحث مهم فرمول های شیمی دهم که در آینده بسیار کاربرد دارد، مبحث ظرفیت اتمها است. در مطالعات مربوط به واکنشهای شیمیایی، الکترونهای لایههای الکترونی آخر اتمها از اهمیت ویژهای برخوردارند و نام مربوط به خود را دارند. به این الکترونها الکترونهای لایه ظرفیت یا الکترونهای والانس گرفته میشود. این الکترونها در لایه آخر الکترونی اتم قرار دارند. این الکترونها به طور معمول مسئولیت شرکت در واکنشهای شیمیایی و تشکیل پیوندها را دارند.
الکترونهای لایههای داخلی اتمها با اضافه شدن شماره گروه در هر ردیف جدول تناوبی تغییر نمیکنند. از طرف دیگر به تعداد الکترونهای والانس با افزایش شماره گروه از چپ به راست، افزوده میشود. پیدا کردن تعداد الکترونهای لایه ظرفیت اتمها از روی شماره گروه آنها کار راحتی است. عناصر گروههای ۱ و ۲ و ۱۳ و ۱۴ و ۱۵ و ۱۶ و ۱۷ و ۱۸ به تعداد یکان شماره گروهشان الکترون والانس دارند. برای مثال اکسیژن در گروه ۱۶ جدول تناوبی است و ۶ الکترون ظرفیت دارد. عنصر هلیم از این قاعده مستثنی است و تنها دو الکترون والانس دارد.
الکترونهای لایه ظرفیت فلزات واسطه (عناصر گروه ۳ تا ۱۳) را نمیتوان طبق این قائده مشخص کرد. عناصر واسطه ممکن است شامل لایههای میانی الکترونی پر نشده باشند به همین دلیل نمیتوان از روی شماره گروه آنها میزان الکترونهای والانس آنها را محاسبه کرد.
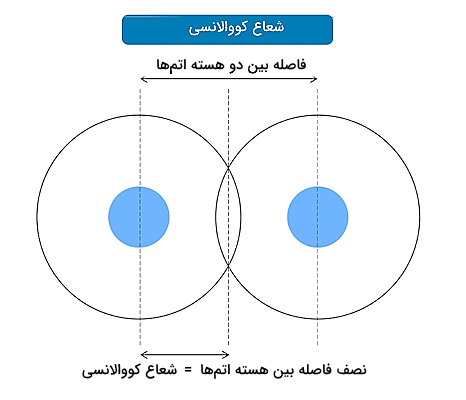
شعاع اتمی کووالانسی
شعاع اتمی کووالانسی برابر با فاصله بین دو اتم از دو مولکول درگیر در یک پیوند کووالانسی است. این فاصله میتواند برابر با نصف فاصله بین هسته آنها در نظر گرفته شود. این کمیت معمولا با واحد اندازهگیری پیکومتر یا آنگستروم مشخص میشود. برای درک بهتر شعاع کووالانسی به تصویر زیر دقت کنید.
یادگیری فرمول های شیمی دهم با فرادرس
درس شیمی در پایه دهم ریاضی و تجربی مبحثهای بسیار مهم پایه شیمی را بیان میکند. یادگیری فرمول های شیمی دهم و حل مسئله به وسیله آنها بسیار حائز اهمیت است. این مباحث پایه دانشآموزان را برای دروس شیمی یازدهم و دوازدهم و کنکور قوی میکند. این فرمولها به مباحثی چون جرم اتمی و مولکولی مواد، ساختار لایهها و زیرلایههای الکترونی، مباحث استوکیومتری، قوانین و رفتار گازها، پیوندهای بین مولکولی و موازنه واکنشها میپردازد. پیشنهاد میکنیم برای یادگیری عمیقتر این مفاهیم و مباحث به مجموعه فیلم آموزش پایه دهم، بخش شیمی مراجعه کنید که با زبانی ساده ولی کاربردی به توضیح این مفاهیم میپردازد.
همچنین با مراجعه به فیلمهای آموزش فرادرس که لینک آنها در ادامه آورده شده است، میتوانید به آموزشهای بیشتری در زمینه فرمول های شیمی دهم دسترسی داشته باشید.
فرمول های شیمی دهم فصل دوم
فرمول های شیمی دهم فصل دوم در جدول زیر ارائه شدهاند.
| مبحث مورد نظر | فرمول های شیمی دهم فصل دوم |
| جرم هواکره (اتمسفر) | تن |
| رابطه ارتفاع و فشار هوا در اتمسفر | هرچه ارتفاع افزایش یابد، فشار کاهش مییابد. |
| فراوانی گازهای هواکره | |
| رابطه دما بر حسب سلسیوس و کلوین | |
| مجموع الکترونهای لایه ظرفیت | مجموع الکترونهای پیوندی و ناپیوندی |
| معادله سوختن کربن | |
| معادله سوختن گاز هیدروژن در حضور کاتالیزور پلاتین | |
| معادله سوختن متان | |
| معادله سوختن پروپان | |
| معادله سوختن اتانول | |
| معادله سوختن گوگرد دی اکسید | |
| معادله تجزیه نیتروگلیسرین | |
| معادله واکنش کلسیم اکسید با کربندیاکسید | |
| معادله واکنش منیزیم اکسید با کربندیاکسید | |
| مجموع واکنشهای لایه اوزون | |
| واکنش نیتروژن و اکسیژن در اثر رعد و برق | |
| واکنش تولید اوزون تروپوسفری | |
| واکنش تبدیل گاز گوگرد دی اکسید به گوگرد تری اکسید | |
| رابطه حجم یک گاز با شمار مولهای آن | هر یک مول گاز در شرایط استاندارد ۲۲٫۴ لیتر حجم دارد. |
| رابطه اکسایش گلوکز برای تولید انرژی | |
| واکنش تولید فسفر تریکلرید | |
| فرآیند هابر | |
| واکنش سدیم بورهیدرید و سولفوریک اسید | |
| واکنش سوختن هیدروژن سولفید | |
| واکنش طلا و سدیم سیانید | |
| واکنش سوختن آمونیاک | |
| واکنش کلسیم کلرید و سدیم فلوئورید | |
| واکنش اکسایش چربی شتر |
رابطه تبدیل دما بر حسب سلسیوس و کلوین
واحد اندازهگیری درجه سلسیوس (سانتیگراد) یک واحد قراردادی و جهانی برای دما است و با علامت «» نشان داده میشود. یک واحد دیگر برای اندازهگیری دما کلوین است. واحد کلوین بر اساس آزمایشهایی که دانشمندان انجام دادهاند انتخاب شده است و با واحد درجه کلوین اندازهگیری میشود. این واحد برای پیدا کردن دمای صفر مطلق طراحی شده است. دمای صفر مطلق برابر با منفی ۲۷۳٫۱۵ درجه سانتی گراد در نظر گرفته میشود. رابطه تبدیل واحد درجه کلوین به درجه سلسیوس به شکل زیر است.
در این رابطه T دما بر حسب درجه کلوین K و دما بر حسب درجه سانتیگراد است.
واکنش سوختن
واکنشهای سوختن عموما واکنشهایی به شدت گرماده بین یک ماده اکسید کننده مانند اکسیژن و ماده دیگر هستند. فرآورده این واکنشها معمولا فرم اکسید شده ماده است. در بیشتر واکنشهای سوختن ماده اکسید کننده اکسیژن و ماده اکسید شونده یک هیدروکربن آلی است. هیدروکربنها موادی هستند که در ساختار خود اتمهای کربن و هیدروژن دارند. برای مثال موادی مانند متان، زغال سنگ، چوب و… ساختاری هیدروکربنی دارند. این فرآیندها انرژی را به صورت نو و گرما آزاد میکنند. از فرآیند سوختن هیدروکربنها دو ماده کربندیاکسید و آب تولید میشود.
معادله واکنش سوختن هیدروکربنها به شکل زیر است.
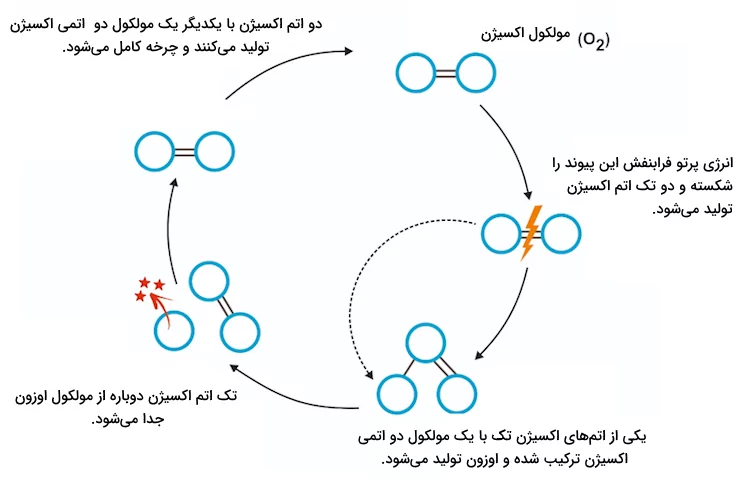
چرخه اوزون
در بررسی فرمول های شیمی دهم نگاهی کلی به واکنشهای زیست محیطی خواهیم داشت. لایه استفراتوسفر جو زمین از یک چرخه مداوم بین مولکولهای اکسیژن موجود در جو و پرتو فرابنفش تولید شده توسط خورشید تشکیل شده است. این فرآیند به عنوان یک چرخه شناخته میشود زیرا فرمهای مختلف مولکول اکسیژن به شکل مداوم به یکدیگر تبدیل میشوند. اوزون یک مولکول گازی تشکیل شده از اتمهای اکسیژن است. لایه اوزون هنگامی تشکیل میشود که پرتوهای فرابنفش با مولکولهای اکسیژن واکنش داده و مولکول دو اتمی اکسیژن را به مولکول سه اتمی اوزون و مولکول تک اتمی اکسیژن رادیکال تبدیل میکنند. این فرآیند به نام چرخه چاپمن نیز شناخته میشود.
چرخه اوزون در تصویر زیر نمایش داده شده است.
فرمول های شیمیایی که در چرخه اوزون بین اوزون و اکسیژن اتفاق میافتد به شکل زیر است.
استوکیومتری واکنش
استوکیومتری در شیمی یکی از مباحث مهم است که روابط کمی بین واکنشدهندهها و فرآورده ها را در یک واکنش شیمیایی بررسی میکند. یکی از مهمترین مباحث استوکیومتری موازنه واکنشها است. بر اساس اصل پایستگی جرم، ضرایب استوکیومتری اتمها باید به شکلی تنظیم شوند که تعداد هر اتم در هر دو سمت واکنش برابر باشد.
برای یادگیری بیشتر در مورد استوکیومتری و موازنه واکنشها میتوانید فیلم آموزش حل موازنه به روش معادله و موازنه کردن واکنش شیمیایی فرادرس که لینک آن در ادامه آورده شده است را مشاهده کنید.
در ادامه روش موازنه واکنشهای شیمیایی که در فرمول های شیمی دهم ارائه شده است را توضیح خواهیم داد.
موازنه واکنشها
در یک معادله موازنه شده، در هر دو سمت واکنش تعداد برابری از عناصر وجود دارد. ضریب استوکیومتری عددی است که در سمت چپ و قبل از علامت شیمیایی مولکولها نوشته میشود و نمایانگر تعداد مولکولهای شرکت کننده در واکنش است. در موازنه واکنشهای شیمیایی این ضرایب باید به شکلی تعیین شوند که از هر عنصر به تعداد برابری در سمت واکنشدهندهها و فرآوردهها وجود داشته باشد. برای درک بهتر موازنه مواد به مثال زیر توجه کنید.
سرب هیدروکسید و سولفوریک اسید طبق معادله واکنش زیر بایکدیگر واکنش میدهند. برای موازنه این معادله واکنش به روش زیر عمل میکنیم.
یکی از سادهترین روشهای موازنه مواد روش وارسی است. در این روش به ترکیبی که بیشترین تعداد اتم و عنصر دارد ضریب ۱ میدهیم و سپس ضریب باقی اتمها و عناصر را نسبت به آن تعیین میکنیم. در این معادله واکنش ترکیب ضریب ۱ میگیرد. با توجه به اینکه این ترکیب ۱ اتم سرب، ۲ اتم گوگرد و ۸ اتم اکسیژن دارد، به ترکیب ضریب ۱ می دهیم تا تعداد اتمهای سرب موازنه شود.
سپس با توجه به اینکه در سمت چپ معادله واکنش تنها سولفوریک اسید شامل اتمهای گوگرد است و در سمت راست معادله واکنش دو اتم گوگرد داریم پس اسید سولفوریک ضریب ۲ میگیرد.
در نهایت نوبت موازنه کردن اتمهای هیدروژن و اکسیژن است. در سمت چپ معادله ۱۲ اتم اکسیژن و ۸ اتم هیدروژن داریم. با ضریب ۴ دادن به آب در سمت راست معادله واکنش، اتمهای اکسیژن و هیدروژن نیز موازنه میشوند.
در نهایت برای مطمئن بودن از موازنه بودن واکنش تعداد اتمها را در هر دو سمت معادله میشماریم.
| عنصر | واکنشدهندهها | فرآوردهها |
| Pb | ۱ | ۱ |
| O | ۱۲ | ۱۲ |
| H | ۸ | ۸ |
| S | ۲ | ۲ |
بدین ترتیب معادله موازنه شده است.

مثال موازنه واکنش
برای تمرین بیشتر موازنه واکنشها، به مثال های زیر توجه کنید.
معادله واکنش سوختن بوتان مایع به شکل زیر است. این معادله را موازنه کنید.
پاسخ
مانند مثال قبل به ترکیبی که بیشترین تعداد اتم را دارد ضریب ۱ میدهیم. این ترکیب بوتان است. با ضریب ۱ دادن به بوتان، میتوانیم تعداد کربنها را در سمت فرآوردهها موازنه کنیم. بوتان ۴ کربن دارد پس کربن دی اکسید ضریب ۴ میگیرد.
در مرحله بعد میتوان هیدروژنها را نیز با توجه به ضریب بوتان موازنه کرد. بوتان ۱۰ اتم هیدروژن دارد پس مولکول آب ضریب ۵ میگیرد تا تعداد هیدروژنهای آن نیز به ۱۰ برسد.
در مرحله اخر باید تعداد اکسیژنها را موازنه کنیم. در سمت فرآوردهها ۱۳ اتم اکسیژن داریم. در سمت فرآوردهها مولکول دو اتمی اکسیژن داریم پس باید ضریبی نصف ۱۳ بگیرد.
در نهایت برای از بین بردن کسر ایجاد شده به تمامی واکنش ضریب ۲ می دهیم و معادله موازنه میشود.
در مطلب زیر از مجله فرادرس، به توضیح کامل موازنه مواد به همراه مثال و راه حل پرداختهایم.
کسرهای تبدیل استوکیومتری
همانطور که در قسمتهای قبل بررسی کردیم، استوکیومتری واکنش راهی برای بررسی روابط کمی بین واکنشدهندهها و فرآوردههای واکنش است. با استفاده از واکنشهای موازنه شده، میتوانیم به نسبت واکنشدهندهها و فرآوردهها پیببریم و تشخیص دهیم برای انجام شدن واکنش چه نسبتی از واکنش دهندهها با یکدیگر ترکیب میشوند. برای محاسبات به این شکل، از کسر تبدیلهای استوکیومتری استفاده میکنیم. برای فهم بهتر این موضوع به مثال زیر توجه کنید.
در معادله واکنش بالا برای تولید یک مول کلسیم نیترات باید ۲ مول نقره نیترات و یک مول کلسیم کلرید با یکدیگر واکنش دهند. به همین ترتیب برای تولید ۴ مول کلسیم نیترات باید ۴ مول نیترات نقره و ۲ مول کلسیم کلرید با یکدیگر واکنش دهند. به بیان سادهتر، نیترات نقره و کلسیم کلرید به نسبت ۲ به ۱ با یکدیگر واکنش میدهند. حال از این نسبت میتوانیم برای حل مسائل پیچیدهتر استوکیومتری استفاده کنیم. به مثال زیر توجه کنید.
در معادله واکنش بالا، چه حجمی از کلسیم کلرید ۰٫۵۵۵ مولار باید با ۱٫۲۵ مول از کلسیم کلرید واکنش دهد؟
با دانستن نسبت واکنش کلسیم کلرید و نیترات نقره میتوانیم به شکل زیر مقادیر را محاسبه کنید.
برای تمرین بیشتر استفاده از این کسر تبدیلها به مثالهای زیر توجه کنید.
مثال اول کسرتبدیل استوکیومتری
چه حجمی از ۰٫۰۹۹۵ مولار آلومینیوم نیترات با ۳٫۶۶ گرم نقره طبق واکنش زیر ترکیب میشود؟
پاسخ
برای به دست اوردن مقدار خواسته شده، ابتدا باید جرم نقره را به مول آن تبدیل کنیم و سپس از نسبت واکنش آنها استفاده کنیم. این محاسبات به شکل زیر انجام میشوند.
مثال دوم کسرتبدیل استوکیومتری
آب اکسیژنه برای اندازهگیری مقادیر منگنز استفاده میشود. معادله واکنش این فرآیند به شکل زیر است.
چه جرمی از محلول ۳ درصد جرمی آب اکسیژنه برای واکنش با ۰٫۳۵۵ مول نیاز است؟
پاسخ
به دلیل اینکه صورت سوال مقدار مول اولیه را به ما داده است، فقط کافی است با استفاده از معادله واکنش موازنه شده و کسرهای تبدیل مناسب استفاده کنیم تا به مقدار جرم محلول دست بیابیم. این محاسبات به روش زیر انجام می شوند.

رفتار گازها
گازها بر خلاف مایعات و جامدات تراکمپذیر هستند و جنبش مولکولی آنها نسبت به جامدات و مایعات بیشتر است. مولکولهای گاز رفتارهایی متفاوت از مایعات و جامدات دارند به این صورت که تغییر دما و فشار تغییر بیشتری در رفتار مولکولهای گاز ایجاد میکند. در ادامه رفتار گازها را توضیح خواهیم داد.
قانون بویل
در فشارهای بالاتر، مولکولهای گاز فشرده شده و به یکدیگر نزدیک میشوند. به بیان دیگر مولکولهای گاز در صورت قرار داشتن در حجمی کوچکتر به یکدیگر نزدیک شده و فشار بیشتری به ظرف وارد میکنند. برای مثال اگر در یک ظرف تعداد مشخصی مولکول گاز داشته باشیم و با حرکت دادن پیستون فشار بر آنها وارد کنیم، حجم آنها کم میشود. این عملکرد مولکولهای گاز با نام قانون بویل شناخته میشود که بیان میکند در دمای ثابت با افزایش فشار گازها، حجم انها کاهش مییابد. قانون بویل به شکل زیر نمایش داده میشود.
در این معادله P نمایانگر فشار و V نمایانگر حجم است.
قانون شارل
اشاره کردیم که مولکولهای گاز در صورت تغییر دما نیز رفتار متفاوتی از خود نشان میدهند. در صورت افزایش دما، مولکولهای گاز دچار جنبش مولکولی بیشتری میشوند. این مسئله باعث میشود در صورت ثابت بودن حجم ظرف، فشار بیشتری به جدارههای ظرف وارد کنند. همچنین اگر فشار ظرف ثابت باشد، افزایش دما باعث جنبش بیشتر مولکولهای گاز شده و باعث میشود حجم بیشتری را اشغال کنند. بررسی تغییرات حجم گاز با تغییر دما در فشار ثابت به وسیله قانون شارل توجیه میشود. در این قانون حجم و دما به شکل زیر با یکدیگر در ارتباط هستند.
در این معادله V نمایانگر فشار و T نمایانگر حجم است.
قانون آووگادرو
برای بررسی راحتتر رفتار گازها، شرایطی برای بررسی این رفتارها مشخص شده است که در آن دما و فشار ثابت است. این شرایط، شرایط استاندارد نام دارد و با حروف انگلیسی STP مشخص میشود. در شرایط استاندارد، دما برابر با صفر درجه سانتیگراد و فشار برابر با ۱ اتمسفر درنظر گرفته میشود. در این شرایط حجم یک مول گاز برابر با ۲۲٫۴ لیتر است. این رابطه توسط آووگادرو ارائه شده و با نام قانون آووگادرو شناخته میشود. با ترکیب قوانین مطرح شده در مورد رفتار گازها میتوان به یک الگوی کلی دست یافت.
فرآیند هابر
فرآیند هابر فرآیندی است که طی آن از نیتروژن و هیدروژن آمونیاک تولید میشود. در این واکنش نیتروژن به دست آمده از هوا با هیدروژن به دست آمده از گاز طبیعی متان با یکدیگر ترکیب شده و گاز آمونیاک را تولید میکنند. این واکنش برگشتپذیر و گرماده است. طی این فرآیند واکنشهای زیر اتفاق میافتند.
در این واکنش با توجه به ضرایب استوکیومتری واکنش حجم گاز نیتروژن و هیدروژن به نسبت ۳:۱ انتخاب میشوند. بازده این واکنش بسیار پایین است و در دما و فشار اتاق به راحتی انجام نمیشود. برای به دست اوردن مقادیر بالای آمونیاک باید شرایط بهینهای برای از دست نرفتن و بازیافت آمونیاک فراهم شود. تصویر زیر سیستم فرآیند هابر را نشان میدهد که در آن دما و فشار واکنش به شکلی تنظیم شدهاند که واکنش به بالاترین بازده خود برسد.
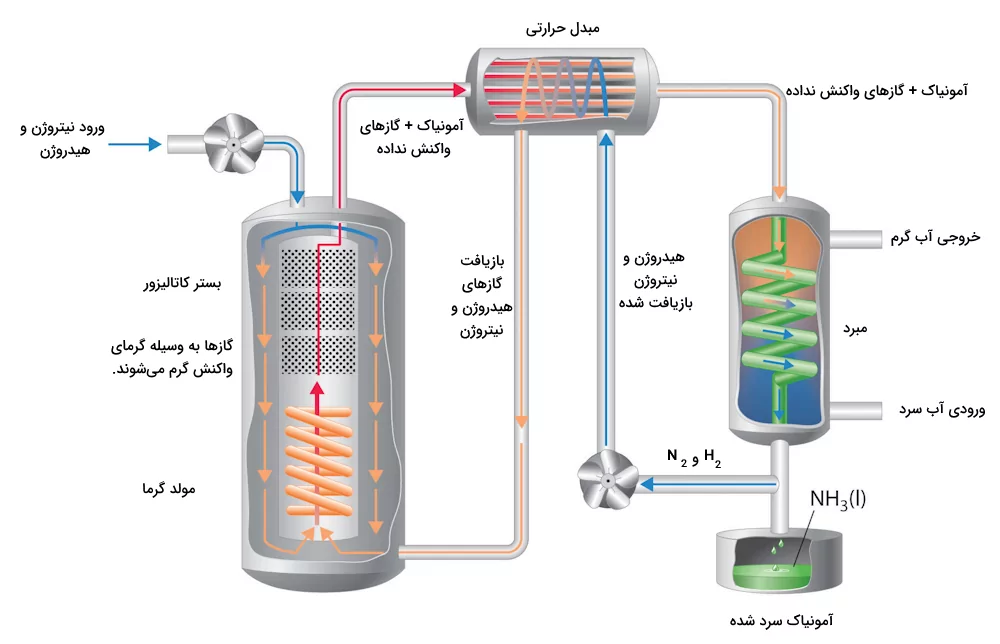
در این فرآیند بهینه سازی شده، گاز نیتروژن و هیدروژن باید در مجاورت بستر ورقه آهنی که واکنش را کاتالیز میکند قرار بگیرند. همچنین هیدروژن و نیتروژن در نهایت واکنش باید جمعآوری شده و به محفظه واکنش بازگردانده شوند. در نهایت نیز آمونیاک به دست آمده سرد و جمعآوری میشود.
فرمول های شیمی دهم فصل سوم
فرمول های شیمی دهم فصل دوم در جدول زیر ارائه شدهاند. در ادامه این مطلب از مجله فرادرس جدول به بررسی نکات مهم این مباحث میپردازیم.
| مبحث مورد نظر | فرمول های شیمی دهم فصل سوم |
| یونهای موجود در آب دریا | |
| واکنش آب مقطر و بلورهای نمک | |
| واکنش آب مقطر و محلول نقره نیترات | |
| واکنش محلول سدیم کلرید و نقره نیترات | |
| واکنش آب مقطر و سدیم فسفات | |
| واکنش آب مقطر و کلسیم کلرید | |
| واکنش کلسیم کلرید و سدیم فسفات | |
| واکنش آب و باریم کلرید | |
| واکنش باریم کلرید و سدیم سولفات | |
| نوشتن فرمول شیمیایی یونهای چند اتمی | نماد کاتیون سمت چپ و نماد آنیون سمت راست بدون بارهای آنها+ تعداد بار آنیون زیروند کاتیون و بالعکس |
| فرمول محاسبه ppm | ppm = جرم حلشونده / جرم محلول × |
| درصد جرمی | جرم حلشونده / جرم محلول × ۱۰۰ |
| درصد حجمی | حجم حلشونده / حجم محلول × ۱۰۰ |
| واکنش تجزیه منیزیم کلرید | |
| غلظت مولار (مولاریته) | |
| انحلال پذیری | گرم حلشونده در ۱۰۰ گرم آب |
| انواع انحلال پذیری مواد | نامحلول < ۰٫۰۱ گرم
۰٫۰۱ < کم محلول < ۱ گرم محلول > ۱ گرم |
| نیروهای بین مولکولی ذرات حلشونده B و حلال A |
فرمول شیمیایی ترکیبات یونی چند اتمی
برای نوشتن فرمول شیمیایی ترکیبات یونی چند اتمی دو قانون ساده وجود دارد که با رعایت کردن آنها می توانیم فرمول شیمیایی بسیاری از ترکیبات یونی را بنویسیم. این قوانین به شکل زیر هستند.
- ابتدا فرمول شیمیایی کاتیون و سپس فرمول شیمیایی آنیون نوشته میشود.
- بار مثبت کاتیون به عنوان زیروند آنیون و بار منفی آنیون به عنوان زیروند برای کاتیون نوشته میشود. تعداد هریک از این یونها را مشخص میکند.
برای مثال به روش نوشتن فرمول شیمیایی ترکیبات سدیم نیترات، کلسیم کلرید و منیزیم کلرید دقت کنید. یونهای این ترکیبات سدیم یک بار مثبت، نیترات یک بار منفی، کلسیم دوبار مثبت، کلرید یک بار منفی و منیزیم دو بار مثبت هستند. ابتدا این یونها را به ترتیب کایتون و سپس آنیون کنار یکدیگر می نویسیم.
- سدیم و نیترات:
- کلسیم و کلرید:
- منیزیم و کلرید:
سپس بار هرکدام از این یون ها را برای یون دیگر بدون علامت و به عنوان زیروند مینویسیم. این اعداد در واقع تعداد هریک از اتمها و مولکولها را تعیین میکنند.
- سدیم نیترات:
- کلسیم کلرید:
- منیزیم کلرید:
قسمت در میلیون ppm
قسمت در میلیون یا ppm در واقع یک واحد بیان غلظت برای محلولها و مخلوطهای کم محلول است. این واحد بیان میکند که در یک محلول یا ترکیب یک ذره ماده حلشونده در یک میلیون واحد محلول قرار دارند. فرمول محاسبه این واحد اندازهگیری به شکل زیر است.
در معادله بالا عبارت انگلیسی «Solute» به معنی حلشونده و «Solvent» به معنی محلول است. گاهی اوقات در فرمول محاسبه ppm به جای جرم محلول از جرم حلال نیز استفاده میشود. درواقع ppm یک واحد مستقل از واحد اصلی اندازهگیری است و کافی است صورت و مخرج کسر آن از یک جنس (حجم، جرم، طول و…) باشد. این واحد اندازهگیری در محاسبات مربوط به محلولسازی در آزمایشگاه شیمی به شدت استفاده میشود.
این واحد اندازهگیری برای بیان غلظتهایی بر حسب درصد حجمی، درصد جرمی، مولاریته، گرم بر لیتر و… نیز به کار میرود.
مثال ppm
اگر میزان ۰٫۵۵۱ میلیگرم از عنصر سدیم در یک نمونه محلول ۳۴۸ گرمی از محلول سدیم باشد، میزان غلظت سدیم را بر حسب ppm در این محلول محاسبه کنید.
پاسخ
با توجه به فرمول ppm جرم حلشونده (گرم) بر جرم محلول (گرم) در یک میلیون واحد برابر با غلظت بر حسب ppm خواهد بود.
درصد جرمی
درصد جرمی نیز یکی دیگر از واحدهای اندازهگیری محلولها و مخلوطها برای نشان دادن درصد یک ماده یا عنصر خاص در کل نمونه است. این واحد اندازهگیری به شکل زیر نمایش داده میشود.
در عبارت بالا عبارت انگلیسی «Solute» به معنی حلشونده و «Sample» به معنی نمونه است. واحد جرم میتواند از هر نوعی باشد و واحد صورت و مخرج کسر باید از یک نوع باشند. برای مثال گرم به گرم، کیلوگرم به کیلوگرم، پوند به پوند و….
مثال درصد جرمی
درصد جرمی نمونه آهن در یک قطعه فلزی با ۸۷٫۹ گرم آهن در نمونه ۱۱۳ گرمی چقدر است؟
پاسخ
باتوجه به فرمول محاسبه درصد جرمی، محاسبات به شکل زیر انجام میشوند.
درصد حجمی
درصد حجمی به عنوان یکی از واحدهای اندازهگیری غلظت محلولها بیان میشود و برابر با نسبت حجم ماده حلشونده به حجم محلول در هر صد واحد است. در محاسبات درصد حجمی باید دقت داشته باشیم که محلول ترکیبی از حلشونده و حلال است و در محاسبات حجم محلول باید برابر با جمع حجم این دو باشد.
این واحد سنجش غلظت تنها برای محلولهایی که در فاز مایع یا گاز هستند استفاده میشود و به عنوان درصد بیان میشود. فرمول محاسبه این واحد از طریق زیر به دست میآید.
$$text{%} text{V/V} = dfrac{ rm{V_{Solute} ; (rm{mL})}}{rm{V_{Solute} ; (rm{mL}) ; + ; V_{Solvent} ; (rm{mL})}}$$
در فرمول بالا عبارت انگلیسی «Solute» به معنی حلشونده و عبارت انگلیسی «Solvent» به معنی حلال است. برای درک بهتر درصد حجمی به مثال زیر توجه کنید.
مثال درصد حجمی
میزان درصد حجمی یک محلول که با مخلوط کردن ۵۱۹٫۲ میلیلیتر هلیوم و ۱۶۸٫۴ میلیلیتر کلر تهیه شده را محاسبه کنید.
پاسخ
از آنجا که صورت سوال مشخص نکرده کدام یک از مواد هلیوم یا کلر حلشونده و کدام یک حلال است باید با مقایسه مقادیر آنها حلشونده و حلال را پیدا کنیم. از آنجا که میزان هلیوم بسیار بیشتر از کلر است، میتوانیم کلر را به عنوان حلشونده و هلیوم را به عنوان حلال درنظر بگیریم. در نتیجه، درصد حجمی کلر در این نمونه برابر با حجم کلر بر جمع حجم کلر و هلیوم در صد واحد است. محاسبات این غلظت به شکل زیر است.
درصد حجمی =
یادگیری شیمی عمومی با فرادرس
بسیاری از مفاهیم پایه که در مقطع دبیرستان آموخته میشوند، پیش زمینهای برای فراگیری مباحث کاملتر در مقطع دانشگاه هستند. مفاهیمی مانند ایزوتوپها، ترازهای انرژی و آرایش الکترونی، خواص گازها و … مفاهیمی هستند که در شیمی عمومی دانشگاهی به شکلی کاملتر توضیح داده میشوند. پیشنهاد میکنیم برای یادگیری کاملتر این مفاهیم به مجموعه فیلم آموزش دروس شیمی دانشگاهی، بخش شیمی عمومی مراجعه کنید که با زبانی ساده ولی کاربردی به توضیح این مباحث میپردازند.
همچنین با مراجعه به فیلمهای آموزش فرادرس که لینک آنها در ادامه اورده شده است، میتوانید به آموزشهای بیشتری در زمینه شیمی عمومی دسترسی داشته باشید.
غلظت مولار (مولاریته)
مولاریته یک محلول به عنوان تعداد مولهای حلشونده در هر لیتر محلول بیان میشود. این روش بیان غلظت یکی از پرکاربردترین واحدهای غلظت در آزمایشگاه شیمی است. فرمول محاسبه این غلظت به روش زیر نوشته میشود.
در این معادله حرف M نشاندهنده غلظت مولار، n تعداد مولهای حلشونده و V حجم محلول است. برای آشنایی بیشتر با این واحد اندازهگیری به مثالهای زیر توجه کنید.
مثال اول مولاریته
محلولی با حل کردن ۲٫۳۵۵ گرم سولفوریک اسید در آب تهیه شده است. حجم کلی محلول ۵۰ میلیلیتر است. میزان غلظت مولار سولفوریک اسید را در این محلول محاسبه کنید.
پاسخ
برای حل کردن این سوال ابتدا باید تعداد مول سولفوریک اسید موجود در ۵۰ میلیلیتر سولفوریک اسید را محاسبه کنیم. جرم مولی سولفوریک اسید ۹۸٫۰۸ گرم بر مول است. برای محاسبه تعداد مول آن به روش زیر عمل میکنیم.
حال با داشتن تعداد مول اسید سولفوریک، میتوانیم غلظت مولار آن را محاسبه کنیم.
مثال دوم مولاریته
میخواهیم ۰٫۲۵۰ لیتر از یک محلول سدیم کلرید ۰٫۸ مولار تهیه کنیم. چه جرمی از سدیم کلرید برای تهیه این محلول نیاز است؟
پاسخ
برای پاسخ به این سوال میتوانیم با استفاده از فرمول غلظت مولار، میزان مول سدیم کلرید محلول را محاسبه کنیم. این محاسبات به شکل زیر هستند.
حال با داشتن مقدار مول سدیم کلرید میتوانیم جرم آن را با توجه به جرم مولی آن محاسبه کنیم. جرم مولی سدیم کلرید برابر با ۵۸٫۴۴ گرم بر مول است. محاسبات برای پیدا کردن گرم سدیم کلرید به شکل زیر است.
مثال فرمول شیمیایی ترکیبات یونی چند اتمی
در جدول زیر که در فصل سوم کتاب شیمی دهم آورده شده است، به نام و فرمول شیمیایی ترکیبات یونی نوشته شده دقت کنید.
| کاتیون / آنیون |
|||||
| یون کلرید | یون نیترات | یون سولفات | یون کربنات | یون هیدروکسید | |
| یون لیتیوم | لیتیوم کلرید | لیتیوم نیترات | لیتیوم سولفات | لیتیوم کربنات | لیتیوم هیدروکسید |
| یون منیزیم | منیزیم کلرید | منیزیم نیترات | منیزیم سولفات | منیزیم کربنات | منیزیم هیدروکسید |
| یون آهن (II) | آهن (II) کلرید | آهن (II) نیترات | آهن (II) سولفات | آهن (II) کربنات | آهن (II) هیدروکسید |
| یون آلومینیوم | آلومینیوم کلرید | آلومینیوم نیترات | الومینیوم سولفات | آلومینیوم کربنات | آلومینیوم هیدروکسید |
| یون آمونیوم | آمونیوم کلرید | آمونیوم نیترات | آمونیوم سولفات | آمونیوم کربنات | آمونیوم هیدروکسید |
source