ایزوتوپها، اتمهایی از عناصر هستند که تعداد پروتون و الکترونهای برابر اما تعداد نوترونهای متفاوتی دارند. هیدروژن اولین عنصر جدول تناوبی است که یک پروتون و یک نوترون دارد. اتم هیدروژن سه ایزوتوپ طبیعی پایدار و چهار ایزوتوپ ناپایدار دارد که در آزمایشگاه تولید میشوند. ایزوتوپ های طبیعی هیدروژن با نامهای پروتیوم، دوتریوم و تریتیوم به ترتیب صفر، یک و دو نوترون در هسته خود دارند. ویژگیهای شیمیایی این ایزوتوپها با یکدیگر یکسان است. در این مطلب از مجله فرادرس به بررسی ایزوتوپ های هیدروژن و ویژگیها و ترتیب پایداری آنها میپردازیم.

در ابتدای این مطلب بررسی میکنیم ایزوتوپ چیست و چه ویژگیهایی دارد. سپس به سراغ ایزوتوپهای اتم هیدروژن رفته و ساختار آنها و میزان پایداری و فراوانی آنها را بررسی میکنیم. مفاهیم مربوط به ایزوتوپها مانند واپاشی، شکافت هستهای، ایزوتوپ مادر و دختر و نیمهعمر را توضیح میدهیم. در آخر میآموزیم رادیوایزوتوپ چیست و ایزوتوپ های هیدروژن چه کاربردهایی دارند. با مطالعه این مطلب تا انتها با این اتمهای مهم و پرکاربرد آشنا شوید.
ایزوتوپ های هیدروژن چیست؟
اتم هیدروژن ۳ ایزوتوپ طبیعی دارد. به این معنا که این ایزوتوپها به شکل طبیعی وجود خارجی دارند و در آزمایشگاه تهیه نشدهاند. این ایزوتوپها با علامتهای و و نشان داده میشوند. ایزوتوپهای و پایدارتر هستند در حالی که ایزوتوپ نیمهعمری برابر ۱۲٫۳۲ سال دارد. ایزوتوپهای سنگینتری برای هیدروژن وجود دارند که با علامتهای تا نشان داده میشوند و نیمهعمر آنها کمتر از ۱ زپتوثانیه است. ( ثانیه). در بین این ایزوتوپها ، کمترین پایداری و بیشترین پایداری را دارند.
هیدروژن تنها عنصری است که ایزوتوپهایش با نامهای متفاوتی شناخته میشود. ایزوتوپ دوتریوم، و ایزوتوپ تریتیوم نام دارند. این ایزوتوپها همچنین با علامتهای D و T نیز نوشته و شناخته میشوند. ایزوتوپ که هیچ نوترونی ندارد، به نام پروتیوم شناخته میشود.
جدول ویژگی های ایزوتوپ های هیدروژن
| ایزوتوپ | جرم اتمی و تعداد نوترون | فراوانی | نیمهعمر |
| پروتیوم | ۱٫۰۰، صفر نوترون | ۹۹٫۹۸ | پایدار |
| دوتریوم | ۲٫۰۲، یک نوترون | ۰٫۰۱۴۵ | پایدار |
| تریتیوم | ۳٫۰۲، دو نوترون | ناچیز | ۱۲٫۳۲ سال |
| هیدروژن – ۴ | ۴٫۰۲، سه نوترون | ناچیز | ۱۳٫۹ زپتوثانیه |
| هیدروژن – ۵ | ۵٫۰۳، چهار نوترون | ناچیز | ۸۶۱ زپتوثانیه |
| هیدروژن – ۶ | ۶٫۰۴، پنج نوترون | ناچیز | ۲۹٫۴ زپتوثانیه |
| هیدروژن -۷ | ۷٫۰۵، شش نوترون | ناچیز | ۶۵٫۲ زپتوثانیه |
ایزوتوپ چیست؟
اتمها از یک ابر الکترونی اطراف هسته اتم خود تشکیل شدهاند. این ابر الکترونی صدهزار برابر کوچکتر از پروتونها و نوترونها است. تعداد پروتونهای هسته، عدد اتمی و نوع عنصر را مشخص میکند. برای مثال هسته اتم عنصر استرانسیوم همواره ۳۸ پروتون دارد و هسته اتم روبیدیوم همواره ۳۷ پروتون دارد. از آنجا که پروتونها بار مثبت و الکترونها بار منفی دارند، اطراف هسته اتم تعداد برابری الکترون وجود دارد تا اتمها از لحاظ بار الکتریکی خنثی بمانند. این الکترونها، ویژگیهای شیمیایی اتمها را مشخص میکنند. این الکترونها بنای ایجاد ترکیباتی مانند استرونیم کلراید هستند که در آنها اتمهایی مانند استرانسیوم و کلر پیوند شیمیایی برقرار کرده اند.
ایزوتوپها اتمهایی از یک عنصر یکسان هستند که تعداد برابری پروتون دارند اما تعداد نوترونهای آنها متفاوت است. بدین معنا که عدد جرمی آنها با یکدیگر فرق دارد. عدد جرمی که با حرف A نشان داده میشود، مجموع تعداد پروتونها و نوترونهای یک اتم است. برای اتم هیدروژن، ۳ ایزوتوپ طبیعی وجود دارد که که با نمادهای و و نشان داده میشود. «هیدروژن ۱» یا «پروتیوم»، رایج ترین ایزوتوپ هیدروژن است. این ایزوتوپ، ۹۹٫۹۸ درصد اتمهای هیدروژن را تشکیل میدهد و هیچ نوترونی ندارد. «هیدروژن ۲» و «هیدروژن ۳» به ترتیب یک و دو نوترون دارند و بیشتر به شکل آزمایشگاهی تولید میشوند. هیدروژن چهار ایزوتوپ دیگر نیز دارد ( تا ) که همگی به شکل آزمایشگاهی تولید شده و بسیار ناپایدارند.

یک نمونه دیگر از موادی که تعداد زیادی ایزوتوپ دارد، استرانسیوم است که این ایزوتوپها بین ۴۴ تا ۵۲ نوترون دارند.
علائم نشان دهنده ایزوتوپ
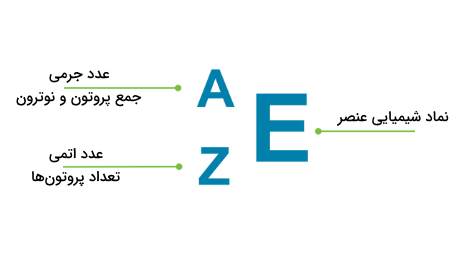
ایزوتوپها به شکلهای مختلفی نشان داده میشوند. رایجترین نماد ایزوتوپها، نام عنصر مربوطه و سپس عدد جرمی آن است. برای مثال و برای ایزوتوپهای اتم هیدروژن نوشته میشوند. ایزوتوپها همچنین میتوانند به شکل دیگری نیز نوشته شوند که در آن ابتدا عدد جرمی، سپس عدد اتمی و سپس علامت عنصر نوشته میشود. عدد جرمی در سمت چپ و بالای علامت عنصر، و عدد اتمی در سمت چپ و پایین علامت عنصر نوشته میشوند. با این که عدد اتمی میتواند نشان دهنده علامت عنصر نیز باشد، رایج است که تنها عدد جرمی اتم در سمت چپ و بالای علامت عنصر آن نوشته شود. برای مثال علامت برای کربن ۱۴ نوشته میشود. اگر مجموعه حروف «-m» پس از عدد جرمی نوشته شود، نشان دهنده پایداری ایزوتوپ مشخص شده است. برای مثال نشان دهنده ایزوتوپ پایدار تکنسیم با عدد جرمی ۹۹ است.
در تصویر زیر فرم رایج نشاندهنده ایزوتوپها را مشاهده میکنید.
ویژگیهای ایزوتوپها
ایزوتوپهای یک عنصر مشخص، تقریبا ویژگیهای فیزیکی و شیمیایی مشابهی دارند اما ویژگیهای مربوط به هسته اتم آنها متفاوت است. برخی از ایزوتوپها «پایدار» هستند درحالی که به برخی دیگر «ناپایدار» میگویند. بیشتر ایزوتوپهایی گه به شکل طبیعی وجود دارند، پایدار هستند. بدین معنی که هسته اتم آنها دچار تغییر نمیشود.
یک ایزوتوپ میتواند رادیواکتیو نیز باشد. این امکان در صورتی به وجود میآید که هسته آن قابلیت تغییر داشته باشد. مدت زمانی که طول میکشد تا یک اتم رادیواکتیو (رادیو ایزوتوپ) به پایداری برسد، نیمهعمر آن نام دارد. که با علامت نشان داده میشود. این عبارت نشان دهنده مدت زمانی است که طول میکشد تا نصف ماده از بین برود یا واپاشی پیدا کند. این نیمهعمر میتواند زمانی بین ۰.۱ میلیثانیه (در مورد ایزوتوپ 215 – At) تا میلیاردها سال (U – 238) طول بکشد.
عناصر میتوانند همزمان ایزوتوپهای پایدار و ناپایدار داشته باشند. برای مثال عنصر استرانسیوم ۴ ایزوتوپ پایدار ۸۴ ، ۸۶، ۸۷ و ۸۸ دارد و یک ایزوتوپ آن ایزوتوپ رادیواکتیو Sr-۸۲ است. طی گذشت زمان، این ایزوتوپ تبدیل به ایزوتوپ روبیدیوم ۸۲ با نیمهعمر ۲۵ روز میشود. ۲۶ عنصر از عناصر کشف شده تنها یک ایزوتوپ پایدار دارند. در این میان عنصر قلع با ۱۰ ایزوتوپ پایدار، بیشترین تعداد ایزوتوپهای پایدار را دارد.
یادگیری ایزوتوپها با فرادرس
ایزوتوپها اتمهایی هستند که تعداد نوترونهای بیشتری نسبت به اتم عنصر اصلی دارند. ایزوتوپها به دلیل خاصیت پرتوزایی یکی از مهمترین مواد در تولید انرژی محسوب میشوند. یادگیری و شناخت ایزوتوپها و ویژگیهای آنها یکی از پایهایترین مباحث در شناخت ساختار اتمها است. این مبحث در شیمی علوم هشتم آموزش داده میشود. برای یادگیری ایزوتوپها و ساختار و ویژگیهای آنها باید با مفاهیم ساختار اتم، پروتونها و نوترونها، عدد اتمی و عدد جرمی و… آشنا شد. این مفاهیم به طور کامل و با زبانی ساده در مجموعه آموزش پایه هشتم و در بخش آموزش شیمی پایه هشتم آموزش داده شدهاند. پیشنهاد میکنیم برای یادگیری بیشتر این مباحث به مجموعه فیلم آموزش پایه هشتم مراجعه کنید که در ادامه آورده شده است.
همچنین با مراجعه به فیلمهای آموزشی فرادرس که لینک آنها در زیر آورده شده است، میتوانید به آموزشهای بیشتری در زمینه ایزوتوپها دسترسی پیدا کنید.
ایزوتوپ های طبیعی هیدروژن
همانطور که قبلا اشاره شد هیدروژن دارای سه ایزوتوپ طبیعی و تعدادی ایزوتوپ ناپایدار است. در ادامه این مطلب از مجله فرادرس به بررسی ویژگیهای ایزوتوپهای پایدار هیدروژن میپردازیم.
ایزوتوپ پروتیوم
این ایزوتوپ رایجترین ایزوتوپ هیدروژن است که فراوانی آن بیش از ۹۹٫۹۸ درصد است. هسته این ایزوتوپ تنها از یک پروتون تشکیل شده است. به همین علت به این ایزوتوپ پروتیوم نیز گفته میشود.
ایزوتوپ دوتریوم ( یا )
یکی دیگر از ایزوتوپهای پایدار هیدروژن دوتریوم است که هسته آن از یک نوترون و یک پروتون تشکیل شده است. دانشمندان عقیده دارند تمامی دوتریومهای موجود در جهان در زمان انفجار بیگ بنگ تولید شده اند و تا به امروز باقی مانده اند. دوتریوم خاصیت پرتوزایی ندارد و هیچ مقداری از آن سمی نیست. آبی که درون مولکولهای خود بجای هیدروژن از دوتریوم تشکیل شده باشد به نام آب سنگین شناخته میشود. دوتریوم و ترکیباتش با نشان غیرپرتوزا در آزمایشگاه مشخص میشوند.
آب سنگین برای تولید نوترون و همچنین به عنوان سردکننده راکتورهای هستهای به کار میرود. دوتریوم همچنین برای سوخت فرایندهای تجاری واپاشی هستهای به کار میرود. این ایزوتوپ فراوانی زیادی در برخی از آبهای طبیعی دارد. برای مثال، مقادیر زیادی از این ایزوتوپ در آبهای آمریکای شمالی یافت میشود. واکنشهای شیمیایی این ایزوتوپ مانند اتم هیدروژن است. هرچند تفاوتهایی در انرژی پیوند و طول پیوند این ایزوتوپ با سایر ایزوتوپها مشاهده شده است. پیوندهای شیمیایی که این اتم تشکیل میدهد به اندازهای بزرگ است که پاسخهای متفاوتی را در فرایندهای بیولوزیک میدهد.
ایزوتوپ تریتیوم ( یا )
سومین ایزوتوپ هیدروژن تریتیوم نام دارد. این ایزوتوپ هیدروژن یک پروتون و دو نوترون در هسته خود دارد. این ایزوتوپ رادیواکتیو است و به ایزوتوپ هلیوم-۳ واپاشی میکند. نیمهعمر این ایزوتوپ ۱۲٫۳۲ سال است.این ایزوتوپ به اندازهای رادیواکتیو هست که برای تولید رنگهای شبرنگ استفاده شود. مقادیر ناچیزی از این ایزوتوپ به شکل طبیعی با تابش پرتوهای کیهانی با گازهای اتمسفر تولید میشود. تریتیوم همچنین در فرایند آزمایش سلاحهای هستهای نیز آزاد میشود. از این ایزوتوپ در فرایند شکافتهای هستهای نیز استفاده میشود. روش تولید این ایزوتوپ در آزمایشگاه از طریق تاباندن پرتوهای بتا به اتم هلیوم است.
تریتیوم تنها ایزوتوپ طبیعی هیدروژن است که خاصیت پرتوزایی دارد. این ایزوتوپ پرتوهای بتا () که انرژی کمی دارند را از خود ساطع میکند.

ایزوتوپ های ناپایدار هیدروژن
ایزوتوپهای ناپایدار هیدروژن دارای نیمهعمری کوتاه بوده و در آزمایشگاه تولید میشوند. در ادامه این ایزوتوپها توضیح داده شدهاند. این ایزوتوپها به مرور زمان نوترونهای اضافی خود را از دست میدهند. از بین این ایزوتوپها بیشتر پایدار است و کمترین پایداری را دارد.
ایزوتوپ
از بین ایزوتوپ های هیدروژن، این ایزوتوپ هیدروژن بسیار ناپایدار است و هسته آن از سه نوترون و یک پروتون تشکیل شده است. این ایزوتوپ در آزمایشگاه به وسیله بمباران تریتیوم با نوترون هسته دوتریومهای پرشتاب انجام میشود. در این فرایند هسته تریتیوم، نوترون را از دوتریومهای در حرکت جدا میکند و تبدیل به ایزوتوپ میشود.
ایزوتوپ
هسته این ایزوتوپ ناپایدار هیدروژن از ۴ نوترون و یک پروتون تشکیل شده است. این ایزوتوپ با بمباران تریتیوم با دو نوترون هسته پرشتاب تریتیوم انجام میشود. در این فرایند، هسته تریتیوم ۲ نوترون از تریتیوم دیگر دریافت میکند. این ایزوتوپ از طریق از دست دادن نوترون دچار واپاشی شده و نیمهعمر آن ثانیه است.
ایزوتوپ
ایزوتوپ دارای ۵ نوترون و یک پروتون است. این ایزوتوپ از طریق از دست دادن ۳ نوترون دچار واپاشی میشود. نیمهعمر این ایزوتوپ است. روش تولید این ایزوتوپ در آزمایشگاه از طریق تاباندن یک نوترون به ایزوتوپ انجام میشود.
ایزوتوپ
این ایزوتوپ از یک پروتون و ۶ نوترون تشکیل شده است و بسیار ناپایدار است. این ایزوتوپ اولین بار از بمباران هیدروژن با اتم هلیوم تولید شد. روش تولید این ایزوتوپ در آزمایشگاه از طریق تاباندن ۴ نوترون به ایزوتوپ تریتیوم انجام میشود.
فراوانی ایزوتوپ های هیدروژن
همانطور که قبلا شاره شد، پروتیوم با ۹۹٫۹۸ درصد فراوانی، رایجترین ایزوتوپ بین ایزوتوپ های هیدروژن است. پس از آن دوترویم با یک نوترون بیشترین فراوانی را دارد. سایر ایزوتوپهای هیدروژن پایدار نیستند و پس از مدتی دچار واپاشی شده و نوترونهای اضافه هسته خود را از دست میدهند.
پس از دوتریوم، تریتیوم بیشترین فراوانی را دارد و نیمهعمر آن حدود ۱۲ سال است. سپس ایزوتوپ «هیدروژن -۵» با ۸۶۱ زپتو ثانیه بیشتر میتواند وجود داشته باشد. با اینکه این نیمهعمر مقدار ناچیزی به حساب میاید، این ایزوتوپ از سایر ایزوتوپهای ساختگی هیدروژن پایدارتر است. پس از آن به ترتیب «هیدروژن -۷»، «هیدروژن -۶» و «هیدروژن -۴» به ترتیب فراوانیهای ایزوتوپها را به خود اختصاص داده اند.
رادیوایزوتوپ چیست؟
یک ایزوتوپ میتواند درصورت امکان «رادیواکتیو» باشد. این امکان در صورتی به وجود میآید که هسته آن قابلیت تغییر داشته باشد. این تغییر بدین صورت است که خاصیت رادیواکتیوی به مرور زمان دچار واپاشی میشود. این واپاشی رادیواکتیوی، طی گذشت مدت زمانی مشخص اتفاق میافتد. طی این فرایند واپاشی رادیواکتیوی، ایزوتوپ اصلی یا «ایزوتوپ مادر» تبدیل به «ایزوتوپ دختر» میشود که احتمالا نشانگر یک عنصر متفاوت است.
ایزوتوپها میتوانند به شکل طبیعی از طریق واپاشی هستهای تشکیل بشوند. این فرایند شامل نشر انرژی از ذرات الفا، بتا، نوترونها و پروتونها است. ایزوتوپها همچنین میتوانند به شکل مصنوعی به طریق بمباران یک هسته پایدار با ذرات باردار به وسیله شتاب دهندههای هسته به وجود بیایند. این فرایند میتواند منجر به تولید یک ایزوتوپ از همان عنصر یا تولید ایزوتوپ یک عنصر جدید شود. ایجاد ایزوتوپ عنصر جدید از طریق فرایندی به نام تبدیل هستهای (تراجهش) اتفاق بیافتند. یعنی به مرور زمان ایزوتوپهای ناپایدار نوترونهای اضافی خود را از دست میدهند.
معمولا به یک زنجیره از واپاشی رادیواکتیوی ایزوتوپهای دختر، زنجیره واپاشی میگویند. این زنجیره باید تا رسیدن به یک هسته پایدار ادامه پیدا کند. مدت زمانی که طول میکشد تا یک اتم رادیواکتیو (رادیو ایزوتوپ) به پایداری برسد، نیمهعمر آن نام دارد. که با علامت نشان داده میشود. این عبارت نشان دهنده مدت زمانی است که طول میکشد تا نصف ماده از بین برود یا واپاشی پیدا کند. این نیمهعمر میتواند زمانی بین ۰.۱ میلیثانیه (در مورد ایزوتوپ 215 – At) تا میلیاردها سال (U – 238) طول بکشد.
با واپاشی طبیعی رادیوایزوتوپها، ذراتی از ماده انرژی از دست میدهند. این انرژی به ذرات موجود در محیط اطراف آنها مانند هوا، آب یا حتی بدن انسانها منتقل شده و از آنها عبور میکند. انرژی ذرات آلفا قدرت زیادی ندارد و از کاغذ نیز عبور نمیکند. ذرات بتا با انرژی بیشتر از کاغذ عبور کرده و از ورقه آلومینیوم عبور نمیکنند. فوتونهای پرانرژی مانند پرتوهای ایکس و گاما به راحتی از بسیاری از سطوح و بدن انسان عبور میکند و تنها با حفاظت با لایه سربی میتوان از عبور آنها جلوگیری کرد. پرتوزایی نوترون به عنوان خطرناکترین و پرقدرتترین نوع پرتوها برای انسانها در نظر گرفته میشود و انرزی سینتیکی بسیار زیادی دارد. معمولا لایههای ضخیم سیمان و بتن میتواند سد عبوری مناسب برای این نوع پرتو باشد. عناصری که عدد اتمی پایینی دارند مانند آب، کربن، لیتیوم و… میتواند سرعت پرتوهای نشر شده از نوترونها را کاهش داده و لایههای محافظتی خوبی را به وجود بیاورند.
کاربرد ایزوتوپ های هیدروژن
ایزوتوپها برای انجام تحقیقات، شناسایی بیماریها و فرایندهای امنیتهای بین المللی استفاده میشوند. معمولا خاصیت پرتوزایی مواد به عنوان یک خطر برای سلامتی انسانها در نظر گرفته میشود. بااین حال ایزوتوپهای پرتوزای هیدروژن در داروسازی و تشخیص پزشکی بسیار ارزشمند شمرده میشوند. از ایزوتوپ دوتریوم در داروسازی، سلاحهای هستهای، اسپکتروسکوپی NMR و راکتورهای هستهای استفاده میشود.
از ایزوتوپ تریتیوم نیز در شیمی تجزیه، فغرایندهای شکافت هستهای کنترل شده، شناسایی نوترونها، و ردیابهای دریایی ناپایدار استفاده میشود. همچنین با ردیابی الگوهای وجود ایزوتوپ دوتریوم و به عبارت دیگر آب سنگین در اقیانوسها، الگوهای مهاجرتی برخی از گونهها مشخص میشود.
جمعبندی
در این مطلب مجله فرادرس آموختیم ایزوتوپها اتمهایی هستند که تعداد بیشتری نوترون نسبت به اتم عنصر اصلی دارند. تمامی اتمها دارای ایزوتوپ هستند. دو نوع ایزوتوپ پایدار و ناپایدار وجود دارد. ایزوتوپ های هیدروژن به سه ایزوتوپ اصلی ، و دارد که با نامهای پروتیوم، دوتریوم و تریتیوم شناخته میشوند. این اتم همچنین ۴ ایزوتوپ ناپایدار از تا دارد که تنها به روش مصنوعی و در آزمایشگاه تولید میشوند. هیدروژن تنها اتمی است که ایزوتوپهای آن نامهای خاص دارند. این ایزوتوپها در فرایندهای مختلف هستهای کاربردهای فراوانی دارند.
source