واکنشهای شیمیایی اساس توضیح بسیاری از پدیدههایی هستند که در زندگی روزمره و صنعت اتفاق میافتند. دستهبندیهای متفاوتی برای انواع واکنش های شیمیایی ارائه میشود که در بیشتر آنها هفت دستهبندی کلی سنتز، تجزیه، جایگزینی یگانه، جانشینی دوگانه، اکسایش-کاهش، سوختن و واکنش اسید-باز به چشم میخورد. در این مطلب از مجله فرادرس، به بررسی انواع واکنش های شیمیایی و مثالهای آن میپردازیم. همچنین فرمول واکنشهای شیمیایی و کاربرد آنها را بررسی میکنیم. در برخی از این مثالها با سوخت انواع هیدروکربنها و واکنشهای مواد آلی نیز آشنا می شویم.

انواع واکنش های شیمیایی
واکنشهای شیمیایی به طور کلی بر اساس نوع برهمکنش و سطح پایداری در دستههای گوناکونی جای میگیرند. بیشتر انواع واکنشهای شیمیایی بر اساس نوع برهمکنش بین اتمها یا مولکولهای واکنشدهنده به ۷ دستهبندی کلی تقسیم میشوند. این دستهبندیها میتوانند به شناخت صحیحِ فرایندِ واکنش و نتایجی که به همراه دارد، کمک کنند.

یادگیری انواع واکنشهای شیمی با فرادرس
شناخت واکنشهای شیمی و تشخیص آنها از مباحث پایهای علمی هستند که در برای شناخت جهان هستی و سازوکار آن مورد نیاز هستند. برای شناخت انواع واکنشهای شیمی ابتدا باید با مفهوم ساختار اتم، مدلهای اتمی، مولکولها، چگونگی برهمکنش آنها و پیوندهای بین اتمی و بین مولکولی آشنا شویم. سپس با نوع انجام واکنشها و واکنشدهندهها و فراوردهها آشنا شویم. همچنین باید مفاهیمی مانند اسید و باز،pH، نیم واکنشها فلزات و نافلزات و … را فرا بگیریم. پیشنهاد میکنیم از فیلمهای آموزشی حوزه شیمی فرادرس بهره ببرید که با زبانی ساده ولی کاربردی این مطالب را توضیح میدهند. در فهرست زیر به چند مورد از این آموزشها اشاره کردهایم:
همچنین با مراجعه به صفحههای زیر میتوانید به آموزشهای بیشتری دسترسی داشته باشید:
دستهبندی واکنشها بر اساس نوع برهمکنش
بیشتر این واکنشها در دستهبندیهای زیر جای میگیرند.
- سنتزی: واکنشی که طی آن از ترکیب چند واکنشدهنده یک فراورده تشکیل میشود.
- تجزیهای: واکنشی که طی آن یک ماده به چند مولکول تجزیه میشود.
- جایگزینی یگانه(ساده): واکنشی که طی آن یک اتم با اتم دیگری در ترکیب دیگر جایگزین میشود.
- جانشینی دوگانه(ترکیبی): واکنشی که طی آن دو اتم در دو ترکیب جانشین یکدیگر میشوند.
- اکسایش کاهش: واکنشی که در آن درجه اکسایش مواد تغییر میکند.
- احتراق: واکنشی که طی آن اکسیژن مصرف شده و معمولا انرژی زیادی به صورت حرارت یا نور آزاد میشود.
- خنثی شدن: واکنش بین اسید و باز را میگویند. فراورده این واکنشها از نظر اسیدیته خنثی است.
تعریف کوتاهی از واکنش شیمیایی
در ابتدا برای توضیح انواع واکنش های شیمیایی، به اختصار به توضیح مفهوم واکنشهای شیمیایی میپردازیم. واکنشهای شیمیایی، فرایندهایی هستند که در نتیجه برهمکنش دو یا چند ماده اولیه، مواد شیمیایی جدیدی با آرایش متفاوت بهوجود میآورند. به بیان ساده، واکنش شیمیایی فرایندی است که طی آن واکنشدهندهها به فرآوردهها تبدیل میشوند. چگونگی برهمکنش بین واکنش دهندهها براساس ویژگیهای زیر تحت تاثیر قرار میگیرد:
- محل قرارگیری اتمها در ترکیبات
- واکنش پذیری ترکیبات و اتمها
- شرایط محیطی آزمایش (مانند دما، فشار، کاتالیزور،نور و … )
در این فرایندها هیچ اتمی از بین نمیرود و به وجود نمیآید و تنها نوع برهمکنش آنها با یکدیگر تغییر میکند . انواع واکنش های شیمیایی، میتوانند با آزادسازی یا جذبِ انرژی به صورتهای مختلف، همراه باشند. در ادامه، انواع واکنش های شیمیایی را با جزییات بیشتری توضیح میدهیم.
۱. واکنش سنتز چیست؟
واکنش ترکیبی که به عنوان واکنش سنتز نیز شناخته میشود، به واکنشی گفته میشود که در آن ترکیب جدیدی از ترکیب دو یا چند واکنشدهنده به وجود میآید.
فرمول واکنش سنتز
فرمول کلی واکنشهای ترکیب به شکل زیر است:
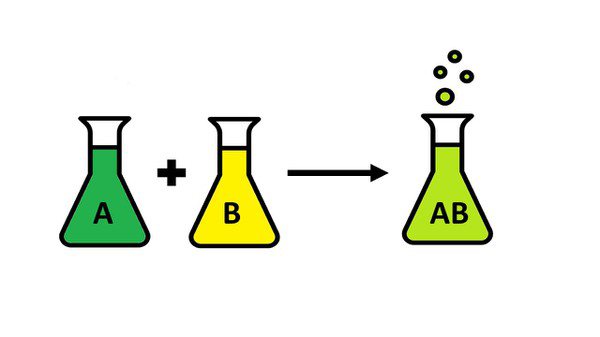
از آنجا که همواره تنها یک فراورده در نتیجه ترکیب دو یا چند ماده بهوجود میآید، شناسایی این نوع واکنشها از روی فراورده آنها بسیار آسان است.
انواع واکنش های شیمیایی ترکیب (سنتز)
یکی از انواع واکنش های شیمیایی، واکنشی است که طی آن دو عنصر با هم ترکیب شود تا یک ترکیب مولکولی واحد به دست بیاید. برای مثال میتوان به فرایند تولید مولکول سدیم کلرید از دو مولکول کلر و سدیم اشاره کرد.
فرمول واکنش تولید سدیم کلرید به این صورت است:
یکی دیگر از مثالهای این واکنش که بیشتر اتفاق میافتد، تولید اکسید نقره از ترکیب فلز نقره و گاز اکسیژن است. فلزات و نافلزات به صورت مداوم تمایل دارند تحت بسیاری از شرایط با مولکول اکسیژن واکنش دهند.
در مثالی دیگر، منیزیم به سرعت و شدت با اکسیژن هوا ترکیب شده و پودر خالص منیزیم اکسید را تولید می کند. در تصویر زیر، روند اکسید شدن نوار منیزیم را مشاهده میکنید.

۲. تجزیه چیست؟
واکنش تجزیه ای به فرایندی گفته میشود که ترکیب پیچیدهتر به اجزای سادهتری طی فرایند شکسته میشود. به بیان دیگر، در واکنش تجزیه، اتفاقی دقیقا عکس فرایند سنتز رخ میدهد.
فرمول واکنش تجزیه
فرمول کلی واکنش تجزیه شکل زیر است:
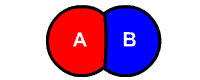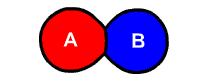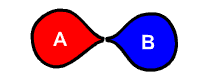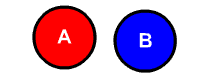
یکی از راههای تشخیص این نوع واکنشها، تشخیص تعداد واکنشدهندهها است. در واکنشهای تجزیه همواره تنها یک واکنشدهنده به اجزای مختلف کوچکتر آن تجزیه میشود. در تصور زیر که نتیجه الکترولیز آب است، مولکول آب به مولکولهای هیدروژن و اکسیژن تجزیه میشود.
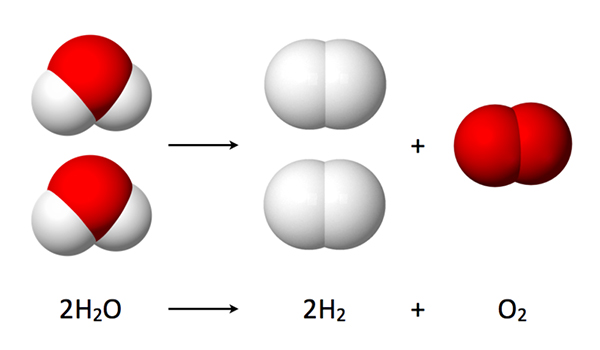
بیشتر انواع واکنشهای شیمیایی تجزیه به انرژی اولیه نیاز دارند. این انرژی میتواند از طریق گرما، نور یا الکتریسیته تأمین شود. سادهترین فرم واکنش تجزیه، زمانی است که مولکول قطبی به اجزای سازندهاش شکسته میشود. ترکیباتی که تنها از دو اتم متفاوت تشکیل شده اند، نوعی مولکول قطبی هستند.
مثال برای انواع واکنش های شیمیایی تجزیه
برای مثال پودر قرمزرنگ اکسید جیوه (II)، که مولکول قطبی است، هنگامی که حرارت داده میشود به اجزای تشکیلدهندهاش، یعنی اکسیژن و جیوه تجزیه میشود.

فرمول کلی انجام این واکنش شیمیایی بهشکل زیر است.
ترکیب همچنین میتواند طی واکنش تجزیه علاوه بر اتمهای سازنده اش، به ترکیب مولکولهای کوچکتر نیز شکسته شود. برای مثال میتوان به واکنشهای فهرست زیر اشاره کرد:
- تجزیه کلسیم کربنات به اکسید کلسیم و کربن دی اکسید: در این واکنش میتوانیم مشاهده کنیم که کلسیم کربنات به جای تجزیه شدن به کلسیم و کربنات به اکسید کلسیم(پودر یا بلور سفید رنگ) و کربن دی اکسید تجزیه شده است. دو مثال بعد نیز نمونههایی از این اتفاق هستند.
- تجزیه سدیم هیدروکسید به اکسید سدیم(پودر سفید رنگ) و بخار آب
- تجزیه کربنات روی به اکسید روی (پودر سفید رنگ) و کربن دیاکسید:
۳. واکنش جایگزینی یگانه چیست؟
در این نوع فرایند که به آن واکنش جانشینی نیز گفته میشود، یک عنصر جایگزین عنصر دیگر در ترکیب میشود.
فرمول انواع واکنش های شیمایی جابجایی یگانه
فرمول کلی این نوع فرایند، به شکل زیر است:
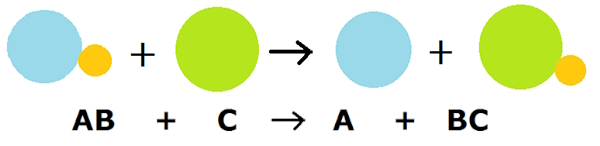
در نوع معمول این نوع واکنش، عنصر A فلز و عنصر B هم فلز دیگر است.
مثالهای واکنش جانشینی یگانه:
منیزیم یک فلز واکنشپذیرتر از مس است .در ادامه متن توضیحاتی درباره واکنشپذیری اتمها آورده شدهاست. هنگامی که نوار فلزی منیزیم را درون محلول آبی نیترات مس II قرار میدهیم، با فلز مس جایگیزین میشود و فراوردههای واکنش منیزیم نیترات و فلز مس جامد خواهند بود:
اگر عنصری که فرایند جایگزینی را انجام میدهد نافلز باشد، باید با یک نافلز دیگر در ترکیب جایگزین شود و فرم کلی معادله به شکل زیر تبدیل میشود:
در واکنش بالا، Y نافلز است و با نافلز Z در ترکیب با X جایگزین میشود.
واکنشپذیری اتمها
یکی از عوامل تعیینکننده انجامپذیری انواع واکنش های شیمیایی جانشینی، میزان واکنشپذیری اتمها است. هنگامی که بدانیم کدام اتمها واکنشپذیرتر هستند، راحتتر میتوانیم تشخیص دهیم که واکنش چگونه انجام میشود. سری واکنشپذیری، ترتیب واکنشپذیری اتمها را در فرایندهای مختلف مانند واکنش جانشینی یگانه مشخص میکند.
بر این اساس، اتمهای واکنشپذیرتر با اتمهایی که کمتر فعال هستند جایگزین میشوند اما عکس این فرایند امکانپذیر نیست.
دو دسته بندی جداگانه برای آنیونها و کاتیونها در سری واکنشپذیری اتمها وجود دارد.
برای اتمهایی که الکترون جذب میکنند(آنیونها) سری واکنشپذیری به شرح زیر است:
F2>Cl2>Br2>I2
فلئور در اتمهای بالا بیشترین و ید کمترین واکنشپذیری را دارند.
مثالهای واکنشپذیری اتمها
در یک مثال دیگر فلز مس با فلز نقره در ترکیب نیترات نقره جایگزین شده و مولکول نیترات مس تولید شده است:
یکی از انواع واکنش های شیمیایی جابجایی یگانه، واکنش اسیدها با فلزات است که در آن مولکولهای هیدروژن اسید آزاد شده و یونهای آزاد آن با فلز واکنش داده و نمک تولید میکنند. در ادامه واکنش اسید کلریدریک با فلز روی آورده شده است.

۴. واکنش جایگزینی دوگانه
در واکنش جایگزینی یا جانشینی دوگانه یونهای مثبت و منفی دو ترکیب یونی جایگزین یکدیگر میشوند و دو ترکیب جدید بهوجود میآورند.
فرمول واکنش جانشینی دوگانه
فرمول کلی واکنش جانشینی دوگانه به صورت زیر است:
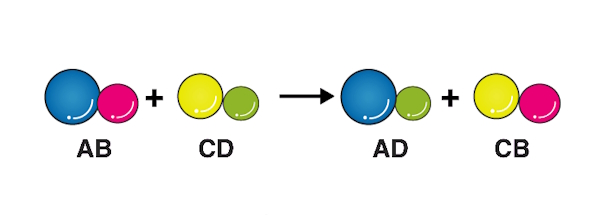
در این فرم A و C یونهای مثبت و B و D یونهای منفی هستند. این واکنشها عموما در فاز آبی صورت میگیرند. برای انجام گرفتن این واکنش، یکی از واکنشگرها باید در فرم مایع، گاز یا فرم مولکولی مانند محلول در آب باشد . هنگامی که در محلول، فرمهای کاتیونی یک ماده با فرمهای آنیونی ماده دیگر وارد واکنش شوند، در آن فاز جامدی شکل خواهد گرفت که ترکیبِ یونیِ غیر قابلِ حلِ حاصل از برهمکنش ایندو است.
مثالهای واکنش جایگزینی دوگانه:
برای مثال، هنگامی که محلول پتاسیم آیوداید و سرب(II)نیترات با هم مخلوط میشوند، واکنش زیر صورت میگیرد:

یک مثال دیگر از این نوع فرایندها واکنش اثر بارانهای اسیدی روی سنگهای مرمری و آهکی نمای ساختمانها و یا مجسمههاست که در آن اسید سولفوریک باعث شسته شدن آهک (کلسیم کربنات) میشود. پیشتر در مجله فرادرس راجع به «اسید سولفوریک» صحبت کردهایم که برای اطلاعات بیشتر میتوانید مطلب مربوطه را مطالعه کنید.

۵. واکنشهای اکسایش کاهش
واکنشهای اکسایش کاهش (ردوکس) هنگامی رخ میدهند معمولا الکترونها در واکنش از یک یون به یک اتم منتقل شده و یک یون یا اتم با بارهای جدید تولید کنند. برای مثال در واکنش تولید سدیم کلراید انتقال الکترونها به شکل زیر صورت میگیرد.
این معادله نشان میدهد که اتم سدیم الکترون از دست میدهد در حالی که اتم کلر (در مولکول Cl2) الکترون دریافت میکند. در این دست واکنشها از دست دادن الکترون را اکسایش و دریافت الکترون را کاهش میگویند. پس در این مثال سدیم اکسید شده و کلر کاهش یافتهاست. به بیانی دیگر، کلر به عنوان اکسید کننده و سدیم به عنوان کاهنده عمل کردهاند.
در برخی دیگر از واکنشهای اکسایش کاهش انتقال الکترون صورت نمیگیرد و صرفا تنها عدد اکسایش اتمها تغییر میابد. برای مثال:
فراورده این واکنش یک ترکیب کووالانسی است پس درواقع، انتقال الکترونی برای انجام واکنش از یک یون به یون دیگر صورت نگرفتهاست. عدد اکسایش یا مرتبهی اکسایش اتم، مقدار بار الکترونی است که اگر مولکولِ ما به صورت ترکیب یونی بود، میتوانست داشته باشد.
در مثال مثابه واکنش دو مولکول فلئور و هیدروژن را داریم:
قوانین تعیین عدد اکسایش
موارد زیر قوانین از پیش تعیین شدهای برای درنظر گرفتن عدد اکسایش هستند:
- عدد اکسایش اتم به حالت عنصر خنثی، صفر است.
- عدد اکسایش یونهای تک اتمی، برابر با بارِ آنها است.
- عدد اکسایش اتمهای نافلز زیر به شرح ذیل است:
- هیدروژن: در ترکیب با غیرفلزات و در ترکیب با فلزات
- اکسیژن : در بیشتر ترکیبات ، در پر اکسیدها ، و در موارد اندکی (در سوپر اکسیدها ) و مقادیر مثبت هنگام ترکیب شدن با
- مجموع عدد اکسایش اتمها در ترکیب چند اتمی برابر با بار آن مولکول یا یون است.
روش صحیح نوشتن عدد اکسایش باید به صورت زیر باشد:
ابتدا عدد و سپس علامت باشد ( برای مثال: ، و …)
بنا بر این تعریف، اکسایش اتمها افزایش درجه اکسایش، و کاهش اتمها کاهش درجه اکسایش درنظر گرفته میشود.
مثالهای واکنش ردوکس
برای مثال در تصویر و معادله زیر واکنش ردوکس مفتول مس را در محلول نقره نیترات مشاهده میکنید:

یکی از عینیترین مثالهای انواع واکنش های شیمیایی اکسایش-کاهش در طبیعت واکنش زنگ زدن آهن است. زنگ آهن در نتیجه واکنش اکسایش-کاهش فلز آهن و گاز اکسیژن، در حضور رطوبت هوا است.

۶. واکنش سوختن چیست؟
واکنشهای احتراق به مجموعهای از واکنشها گفته میشود که در آن ماده با اکسیژن واکنش داده و در نتیجه انرژی را به صورت نور و گرما آزاد میکند. در انواع واکنشهای شیمیایی احتراق(سوختن) حتما اکسیژن به عنوان یکی از واکنشگرها باید وجود داشته باشد.
یکی از مثالهای این نوع واکنش، احتراق گار هیدروژن است. در واکنش احتراق گاز هیدروژن، بخار آب تولید میشود:

واکنشهای احتراق در واقع به نوعی اکسایش-کاهش هستند. بیشتر واکنشهای سوختن از ترکیب هیدروکربنها (ترکیبی که تنها از کربن و هیدروژن تشکیل شده است) و اکسیژن به وجود میآیند. فراوردههای واکنش احتراق (کامل) هیدروکربنها همواره آب و کربندیاکسید است. بیشتر هیدروکربنها به عنوان سوخت استفاده میشوند زیرا فرایند احتراق آنها مقادیر بسیار زیادی انرژی گرمایی تولید میکند.
برای مثال پروپان که یک هیدوکربن گازی است، به طور معمول به عنوان سوختِ اجاقهای گاز (پیکنیکی)، شومینهها، گرمایش منابع آب و… مورد استفاده قرار میگیرد.

انواع واکنشهای سوختن
واکنشهای سوختن میتوانند به چند دستهبندی تقسیم شوند. موارد زیر دستهبندیهای ارائه شده برای واکنشهای سوختن هستند.
- سوختن(احتراق) کامل
این واکنش در صورتِ وجود نداشتن منابع کافی هوا، مخصوصا عنصر اکسیژن رخ میدهد. نام دیگر این نوع واکنش، احتراق تمیز است. برای مثال میتوان به فرایند احتراق شمع اشاره کرد.
- سوختن(احتراق) ناقص
این واکنش درصورتی اتفاق میافتد که منابع کافی اکسیژن در دسترس نباشد. این فرایند انرژی کمتری نسبت به احتراق کامل تولید میکند. برای مثال میتوان به فرایند احتراق کاغذ اشاره کرد.
- سوختن(احتراق) سریع
این واکنش به انرژی گرمایی بسیاری برای آغاز شدن احتیاج دارد. به سرعت مقادیر بسیاری نور و گرما آزاد میکند. برای مثال میتوان به فرایند احتراق کبریت اشاره کرد.
- سوختن(احتراق) خودبهخودی
این واکنش برای انجام گرفتن به انرژی خارجی برای شروع فرایند احتیاجی ندارد. در مواقعی اتفاق میافتد که دمای اشتعال ماده، بسیار کم باشد. برای مثال میتوان به واکنش فلزات قلیایی با آب اشاره کرد.
- سوختن(احتراق) انفجاری
این فرایند به سرعت و شدت انجام میگیرد و مقادیر بسیاری نور، حرارت و صدا ایجاد میکند. برای مثال میتوان به احتراق ترقه و دینامیت اشاره کرد.
مثالهای واکنش سوختن
در فرمول زیر فرایند سوختن پروپان را مشاهده میکنید:
واکنشهای احتراق هیدروکربنها میتواند به صورت کامل یا ناقص صورت بگیرد. سوختن کامل هنگامی اتفاق میافتد که اکسیژن کافی برای سوختن هیدروکربن وجود داشته باشد در حالی که سوختن ناقص زمانی صورت میگیرد که اکسیژن کافی برای سوختن در واکنش نباشد. در این صورت مولکول کربن مونواکسید و کربن پودری(دوده) نیز به عنوان فراوردههای جانبی واکنش تولید میگردند.

واکنش احتراق یا سوختن لزومأ به معنای بههمراه داشتن آتش نیست. اما گرما و نور به صورت انرژی همواره در نتیجه این واکنش، آزاد میشوند. گاه این آزادسازی انرژی میتواند آنقدر آهسته صورت بگیرد که افزایش دما به صورت محسوس قابل مشاهده و اندازهگیری نباشد.
در دو مثال زیر معادله ی سوختن نفتالن (واکنش اول) و متان (تصویر) را مشاهده میکنید.
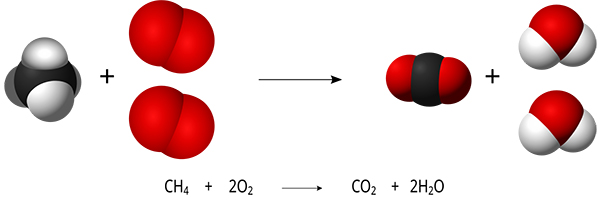
۷. واکنش خنثی شدن چیست؟
واکنش خنثی شدن به واکنش بین اسید و باز میگویند. این دسته از انواع واکنشهای شیمیایی در واقع زیر مجموعه واکنشهای جابجایی دوگانه هستند. بدین صورت که یونهای مثبت هیدروژن آزاد شده توسط اسید و یونهای منفی هیدروکسید آزاد شده توسط باز منجر به تشکیل مولکول آب و یونهای باقی مانده از اسید و باز اولیه نمک آنها را تشکیل میدهند.
pH نهایی محلول پس از واکنش اسید و باز قوی به سمت عدد ۷ نزدیک میشود که پی اچ خنثی است؛ به همین علت است که نام دیگر این نوع واکنشها را واکنشهای خنثی شدن نامیدهاند.

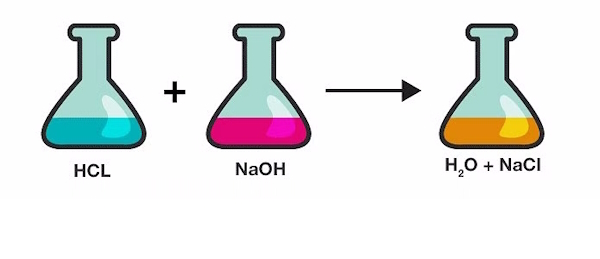
مثال واکنش خنثی شدن
یک مثال پرتکرار از واکنشهای اسید باز واکنش هیدروکلریک اسید و سدیم هیدروکسید(سود سوزآور) است:
دسته بندی واکنشها بر اساس پایداری سطح انرژی فراوردهها
بر اساس اصل پایستگی، اتمها در واکنش نه بهوجود میآیند و نه از بین میروند. بنابراین طی برهمکنش اتمها در انواع واکنش های شیمیایی، انرژی تا به پایداری رسیدن واکنش، فرایند میتواند در یک یا هر دو جهت ادامه پیدا کند. این پایداری سطح انرژی میتواند به وسیله از دست دادن یا جذب انرژی انجام بگیرد.

واکنشهای تعادلی (دوجهتی)
واکنشهای تعادلی واکنشهایی هستند که در حالت عادی هر دو طرف واکنش به صورت پایدار در طبیعت وجود دارند و بین آنها تعادل شیمیایی وجود دارد.
مثال واکنش تعادلی:
واکنش بین حالات مختلف آب(مایع، جامد، گاز)
واکنشهای یک طرفه
واکنشهایی هستند که در آنها یا برای شروع واکنش به انرژی اولیه نیاز است یا فراوردههای واکنش به صورت طبیعی پایدارتر هستند.
مثال واکنش یک طرفه
واکنش تجزیه آب:
برای واکنش تجزیه آب معمولا از روش الکترولیز استفاده میشود که انرژی اولیه واکنش در آن توسط جریان الکتریکی تأمین میشود.
نوع دیگری از واکنشهای یک طرفه، آن دسته هستند که به صورت خودبهخودی درطبیعت صورت میگیرند مانند فرایندخوردگی فلزات که پیشتر اشاره شد.
دسته بندی واکنشها در شیمی آلی
در شیمی آلی ( شیمی هیدروکربنها) علاوه بر واکنشهای یاد شده انواع واکنشهای شیمیایی دیگری نیز وجود دارند که بیشتر مربوط به پیوندهای کووالانسی بین اتمی آنها هستند و برخی از آنها به یاد کاشفان این واکنشها نامگذاری شدهاند. در واکنشهای مواد آلی به علت وجود پیوندهای قوی کووالانسی نیاز به انرژی اولیه بسیاری برای آغاز واکنش وجود دارد. برای مثال از وجود کاتالیست در طی واکنش برای تأمین انرژی و سرعت بخشیدن به واکنش استفاده میشود.
واکنش جانشینی
در واکنش جانشینی یک گروه اتمی متصل به زنجیره کربنی با یک اتم یا یک گروه دیگر جایگزین میشود.این جایگزینیها بسته به نوع آنها میتواند هسته دوست(نوکلئوفیلیک)،الکتروندوست (الکتروفیلیک) یا رادیکالی باشد.
این واکنشها مشابه واکنشهای جانشینی یگانه هستند و یک یا تعداد بیشتری اتم در یک مولکول با یک گروه دیگر از اتمها جایگزین میشود. آکلیلهالیدها توسط جانشینی یک اتمهالوژن با یک اتم هیدروژن تولید میشوند.
مثال واکنش جانشینی در شیمی آلی
برای مثال هنگامی که متان با گاز کلر واکنش میدهد و نور فرابنفش به عنوان کاتالیست استفاده میشود، کلرومتان و هیدروژن کلراید تولید می گردند.
اگر به این واکنش مدت زمان طولانیتری داده شود جانشینی دیگری نیز ممکن است اتفاق بیافتد. دی کلرومتان، تری کلرومتان و تترا کلرومتان به ترتیب فراوردههای این زنجیره واکنش هستند. در تصویر زیر مراحل این واکنش را مشاهده میکنید.
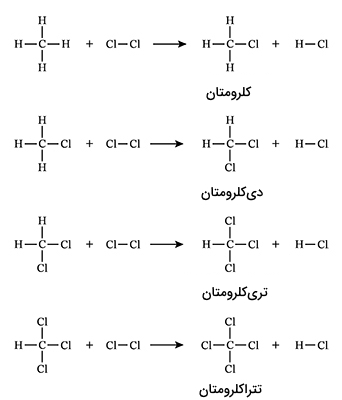
واکنشهای کاهشی
واکنشهای کاهشی یا حذفی مواد آلی ، فرایندی هستند که در آنها کاهش یک پیوند و در نتیجه آن الکترون از روی یک اتم کربن میتواند منجر به ایجاد پیوندهایی یگانه دوگانه یا سهگانه شود. این کار معمولا با جداسازی یون مثبت هیدروژن متصل به یک اتم کربن (هیدروژنه کردن) صورت میگیرد.
مثال واکنش کاهشی در شیمی آلی:
در تصویر زیر میتوانید مشاهده کنید مولکول سیکلوهگزانول گروه الکلی خود را در حضور اسید سولفوریک در دمای بالا از دست داده و به سیکلوهگزن تبدیل شده است.
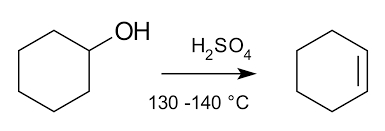
واکنشهای افزایشی
واکنشهای افزایشی دسته واکنشهایی هستند که یک اتم یا مولکول به یک مولکول غیراشباع اضافه شده و مولکول نهایی جدید را تولید میکند. این مولکول اضافه شده میتواند مولکولی مانند هیدروژن، کلر، آب و غیره باشد.
مثال واکنش افزایشی در شیمی آلی:
در واکنش زیر مولکول اتن در حضور کاتالیزور پلاتین با هیدروژن واکنش داده و با جذب الکترون پیوندهای آن، به اتان تبدیل شده است.
واکنشهای باز آرایی (ایزومریزاسیون)
واکنشهایی هستند که یک گروه اتمی با تغییر محل اتصال خود به زنجیره کربنی ایزومرهای خودرا بازسازی میکند. برای مثال گروه آلکیل میتواند در زنجیرهی کربنی به کربن شمارههای مختلف در صورت امکان متصل شود.
مثال واکنش باز آرایی در شیمی آلی
در شکل زیر فرایند بازآرایی بوتان را مشاهده میکنید که دو متیل پروپان در نتیجه آن تشکیل شدهاست.
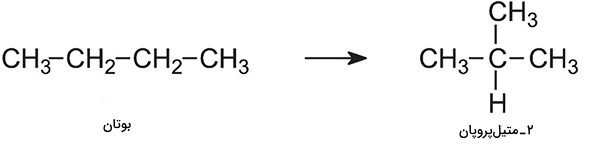
جدول انواع واکنشهای شیمیایی با مثال
در جدولهای زیر چند نمونه مثال از انواع واکنش های شیمیایی آورده شده است که در این مطلب از مجله فرادرس به آنها اشاره شده است.
۱. واکنشهای سنتزی ( ترکیبی)
در جدول زیر، مثالهایی از انواع واکنش های شیمیایی سنتز (ترکیب) به همراه فرمول آن آورده شده است.
| واکنش سنتز | فرمول واکنش |
| ترکیب سدیم و کلر | |
| ترکیب منیزیم و اکسیژن | |
| سنتز کربن دیاکسید | |
| سنتز گوگرد دیاکسید | |
| سنتز گوگرد تریاکسید |

۲. انواع واکنشهای شیمیایی تجزیه ای
در جدول زیر مثالهایی از انواع واکنشهای شیمیایی تجزیه به همراه فرمول آن آورده شدهاست.
| واکنش تجزیه | فرمول واکنش |
| واکنش تجزیه اکسید جیوه | |
| واکنش تشکیل گاز اکسیژن و هیدروژن از مولکول آب اکسیژنه | |
| واکنش تجزیه کلسیم کربنات | |
| واکنش تجزیه پتاسیم کلرات | |
| واکنش تجزیه سدیم کربنات |
۳. واکنش جایگزینی یگانه
در جدول زیر مثالهایی از واکنش جایگزینی یگانه به همراه فرمول آن آورده شدهاست.
| واکنش جایگزینی یگانه | فرمول واکنش |
| واکنش فلز روی با اسید کلریدریک | |
| واکنش کلسیم با آب |
۴. واکنش جایگزینی دوگانه
در جدول زیر مثالهایی از واکنش جایگزینی دوگانه به همراه فرمول آن آورده شدهاست.
| واکنش جانشینی دوگانه | فرمول واکنش |
| واکنش کلرید باریم با سدیم سولفات | رسوب سفیدرنگ |
| واکنش نیترات سرب با پتاسیم آیوداید | رسوب زردرنگ |
| واکنش اسید سولفوریک و باریم هیدروکساید | رسوب سفید یا زرد کمرنگ |
| واکنش نیترات نقره و سدیم کلراید |
۵. انواع واکنشهای شیمیایی اکسایش کاهش
در جدول زیر، مثالهایی از واکنش اکسایش کاهش به همراه فرمول آن آورده شدهاست.
| واکنش ردوکس | فرمول واکنش |
| واکنش اکسیداسیون مس | رسوب سیاهرنگ |
| واکنش فوتوسنتز |
۶. انواع واکنشهای شیمیایی احتراق (سوختن)
در جدول زیر، مثالهایی از واکنش احتراق به همراه فرمول آن آورده شده است.
| واکنش سوختن | فرمول واکنش |
| واکنش سوختن اتانول(الکل طبی) | |
| واکنش سوختن گلوکز (قند ساده) | |
| واکنش سوختن آهن (III) سولفید | رسوب قرمزرنگ |
| واکنش سوختن آلومینیوم سولفید | رسوب سفیدرنگ |
| واکنش سوختن فسفر | رسوب سفید یا زرد کمرنگ |
۷. انواع واکنشهای شیمیایی اسید-باز(خنثی شدن)
در جدول زیر، مثالهایی از واکنش خنثی شدن به همراه فرمول آن آورده شدهاست.
| واکنش خنثی شدن | فرمول واکنش |
| واکنش اسید هیدروفلئوریک و سدیم هیدروکساید | |
| واکنش اسید سولفوریک و پتاسیم هیدروکسید |
source
