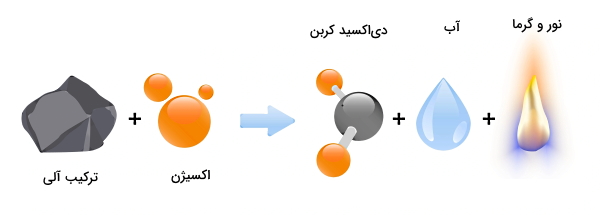
واکنش اکسیژن با مادهای به نام سوخت و تولید یک ماده اکسید شده، «احتراق» (Combustion) نام دارد. احتراق یکی از انواع واکنشهای شیمیایی و گرماده محسوب میشود. اگر مادهای که با اکسیژن واکنش داده است، یک ترکیب آلی مثل گاز متان (CH4) باشد، محصول نهایی در واکنش احتراق کامل، دیاکسید کربن (CO2) و آب خواهد بود. در ادامه این مطلب از مجله فرادرس، با زبانی ساده توضیح میدهیم که احتراق چیست و چه انواعی دارد. همچنین معادله شیمیایی واکنش احتراق را برای چند مثال مختلف با هم بررسی میکنیم.

احتراق چیست؟
به واکنش شیمیایی گرمازای یک ماده سوختنی مثل هیدروکربن با گاز اکسیژن، فرآیند احتراق یا «سوختن» (Burning) گفته میشود. نتیجه چنین واکنشی، تولید گرما و نور است که به شکل شعله دیده میشوند. بسته به مقدار اکسیژنی که برای فرآیند احتراق در دسترس است، سوختن میتواند به دو شیوه ناقص یا کامل انجام شود. اگر بخواهیم یک معادله کلی برای احتراق کامل بنویسیم، این معادله به شکل زیر است:
هیدروکربن + اکسیژن ← گاز دیکسید کربن + بخار آب + گرما و نور
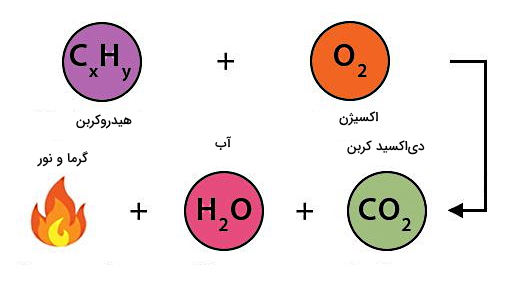
ماده سوختنی در فرآیند احتراق میتواند کربن، هیدروکربن، یا ماده مخلوط پیچیدهتری مثل چوب باشد که شامل هیدروکربنهای بهطور جزئی اکسید شده است. هیدروکربن یک ترکیب آلی بر پایه کربن با فرمول کلی CxHy است. برای مثال گاز متان یا CH4 یک هیدروکربن است. اگر سوخت در احتراق جزء هیدروکربنها نباشد، در این صورت ممکن است یک فلز یا نافلز غیرآلی باشد. نتیجه سوختن چنین موادی، تشکیل اکسید آنها است.
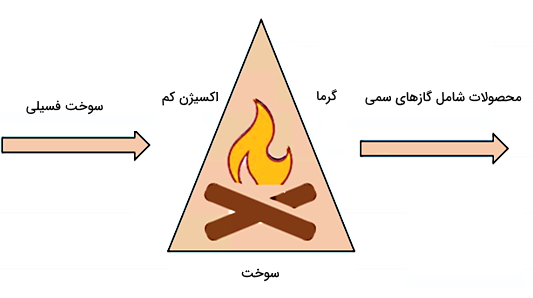
ماده اکسید کننده در احتراق باید دارای پتانسیل اکسیدکنندگی بالایی باشد. موادی که برای این منظور مناسب هستند، عبارتاند از اکسیژن خالص یا اتمسفری، کلر، فلوئور، تریفلورید کلر (ClF3)، نیتروس اکسید (N2O) و اسید نیتریک (HNO3). طبق شکل زیر سه ضلع اصلی مثلث سوختن که همان سه مشخصه فرآیند احتراق هستند، عبارتاند از اکسیژن و سوخت بهعنوان مواد واکنش دهنده و گرما بهعنوان یکی از محصولات نهایی.
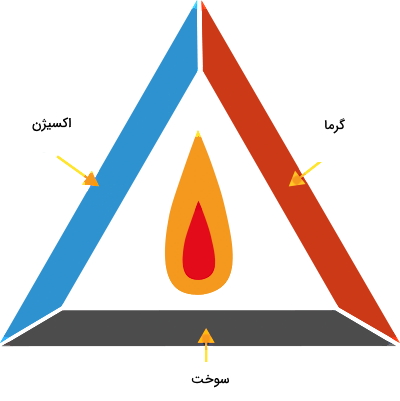
البته احتراق همیشه منجر به تولید آتش نمیشود. در واقع شعله آتشی که با فرآیند احتراق ایجاد میشود، زمانی قابل مشاهده است که مواد در حال احتراق بخار شوند. اگر چنین اتفاقی بیفتد، میتوانیم شعله آتش را یکی از نشانههای رخ دادن فرآیند احتراق در نظر بگیریم. با توجه به اینکه عامل اصلی احتراق اکسيژن است، برای خاموش کردن آتش یکی از اولین اقداماتی که میتوانیم انجام دهیم محدود کردن اکسیژن است. این کار را با استفاده از روشهایی مثل ریختن شن روی آتش یا خفه کردن آتش با پتو میتوانیم انجام دهیم.
احتراق و اکسیداسیون
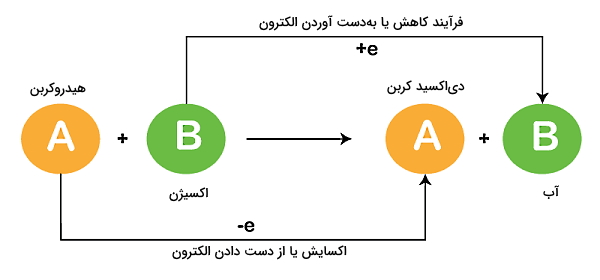
محصول دیگر احتراق، مادهای است که اکسید شده است و عموما به شکل مخلوطی از گازها است و دود نامیده میشود. اگر بخواهیم بهطور دقیقتر بدانیم که احتراق چیست، احتراق هیدروکربن یک واکنش شیمیایی اکسایش – کاهش گرماده با دمای بالا محسوب میشود که بین یک ماده سوختنی (بهعنوان کاهنده) و اکسیژن ایجاد شده است. اگر تمایل دارید در مورد «نقش اکسیدها در فرآوردههای سوختن» بیشتر بدانید، میتوانید فیلم آموزشی شیمی پایه دهم فرادرس را مشاهده کنید که لینک آن در ادامه برای شما قرار داده شده است:
ماده اکسنده یا اکسید کننده معمولا همان اکسیژنی است که در اتمسفر وجود دارد. برای اینکه احتراق اولیه ایجاد شود، لازم است نوعی انرژی فعالسازی مصرف شود (برای مثال همان کبریتی که برای ایجاد شعله استفاده میکنیم). پس از آن، گرمای شعله انرژی لازم برای ادامه خود به خودی فرآیند را فراهم میکند.
همچنین همانطور که اشاره شد، احتراق یا سوختن به دو شکل ممکن است انجام شود، سوختن کامل و سوختن ناقص. در احتراق کامل یا سوختن کامل استوکیومتری ماده سوختنی به شکلی در نظر گرفته میشود که در انتها چیزی از آن باقی نماند. در حالت ایدهآلتر، انتظار داریم در احتراق کامل اکسید کنندهای هم باقی نماند.

اما مسئلهای که وجود دارد این است که احتراق کامل عموما رخ نمیدهد، چون امکان برقراری تعادل شیمیایی در واکنش شیمیایی سوختن همیشه وجود ندارد. در نتیجه، محصولات سوخته نشدهای مثل کربن، هیدروژن یا حتی کربن به شکل دوده یا خاکستر ممکن است باقی بمانند. به همین دلیل است که دود تولید شده در فرآیند احتراق معمولا سمی است، چون شامل محصولات سوخته نشده یا محصولاتی است که کامل اکسید نشدهاند.

بهطور دقیقتر، احتراق یک نوع واکنش ترموشیمیایی محسوب میشود، به این معنا که همواره گرما تولید میکند. همچنین با توجه به اینکه در این فرآیند یک اکسید تولید میشود، میتوان آن را در گروه واکنشهای اکسیداسیون نیز قرار داد، چون همانطور که گفتیم سه مولفه لازم برای اینکه احتراق رخ دهد، عبارتاند از اکسیژن، سوخت و عامل محرک.
نکته دیگر در مورد احتراق این است که احتراق را میتوان در حضور کاتالیزور یا بدون استفاده از آن انجام داد. اما اگر بخواهیم احتراقی بدون حضور کاتالیزور در هوا داشته باشیم، به دمای نسبتا بالاتری نیاز داریم. بنابراین فرآیند سوختن یا احتراق بهندرت یک پدیده تمیز و سالم در نظر گرفته میشود و لازم است قوانین مناسبی به منظور استفاده از مبدلهای کاتالیزوری یا پاکسازی گازهای سوختی اعمال شوند. در بخشهای بعدی به طور مفصل راجعبه انواع احتراق صحبت خواهیم کرد.
پیرولیز در احتراق
در این بخش کمی دقیقتر بررسی میکنیم که احتراق چیست. باید بدانیم این فرآیند واکنشی پیچیدهتر از «واکنشهای ابتدایی» (Elementary Reactions) محسوب میشود. واکنش ابتدایی، همان واکنش شیمیایی ساده است که در آن مواد اولیه بدون اینکه به مرحله واسطهای نیاز داشته باشند، مستقیما به محصول تبدیل میشوند. اما آنچه که در احتراق رخ میدهد به این صورت است که سوختهای جامدی مثل چوب یا زغال، وارد یک فرآیند پیرولیز گرمازا میشوند.
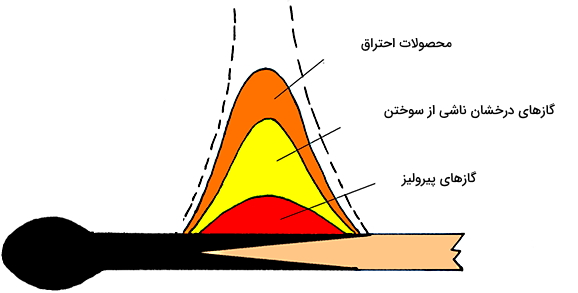
پیرولیز همان تجزیه حرارتی مواد در دمای بالا است و یک فرآیند برگشتناپذیر محسوب میشود. طی این تجزیه حرارتی، گازهایی ایجاد میشوند که احتراق آنها، گرمای لازم برای تولید مقدار گاز بیشتر فراهم خواهد کرد. معمولا احتراق آنقدر داغ هست که بتواند رشته نوری به شکل شعله یا درخششی کوچک ایجاد کند. پس پیرولیز، یکی از مراحل احتراق است.
واکنش شیمیایی چیست؟
پیش از اینکه ببینیم سایر جنبههای فرآیند احتراق چیست، بهتر است ابتدا خصوصیات احتراق را بهعنوان یک «واکنش شیمیایی» (Chemical Reaction) بهتر بشناسیم. واکنش شیمیایی فرآیندی است که در آن یک یا چند ماده با نام واکنش دهنده به یک یا چند ماده متفاوت به نام محصول تبدیل میشوند. این مواد میتوانند عناصر شیمیایی باشند یا بهصورت ترکیبی از دو یا چند عنصر مختلف.
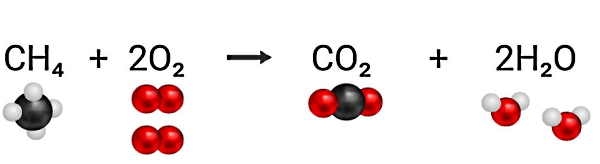
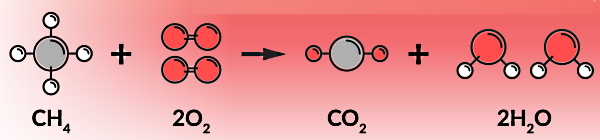
در واقع در یک واکنش شیمیایی طوری اتمهای سازنده مواد واکنش دهنده مجددا چیدمان میشوند که موادی جدید با خصوصیات متفاوت تولید شوند. بنابراین در احتراق نیز بهعنوان یکی از انواع واکنشهای شیمیایی، این خصوصیات وجود دارد. برای مثال، در واکنش سوختن متان، یک مولکول متان با دو مولکول اکسیژن واکنش شیمیایی میدهد. محصول این فرآیند، تشکیل یک مولکول دیاکسید کربن و دو مولکول آب است:
همانطور که مشخص است، خواص آب و دیاکسید کربن کاملا با خواص اکسیژن و متان فرق دارد. پس این فرآیند یک تغییر شیمیایی محسوب میشود، چون مواد جدیدی تولید کرده است. بر اساس محصولاتی که در واکنشهای شیمیایی تولید میشود، تغییراتی که در واکنشدهندهها اتفاق میافتد و مواد واکنشدهندهای که درگیر واکنش هستند، واکنشهای شیمیایی را میتوانیم به انواع مختلفی شامل موارد زیر تقسیمبندی کنیم:
- واکنش احتراق یا سوختن
- واکنش تجزیه
- واکنشهای اکسایش – کاهش
- واکنشهای جانشینی دوگانه
- واکنشهای سنتزی
بنابراین احتراق یکی از انواع واکنشهای شیمیایی محسوب میشود.
مشخصات واکنش شیمیایی
برای اینکه بهتر بتوانید یک واکنش شیمیایی را تشخصی دهید و متوجه شوید احتراق چیست و چه خصوصیاتی دارد، مشخصات این نوع فرآیندها را در ادامه برای شما قرار دادهایم:
- خروج گاز
- شکلگیری نوعی رسوب
- تغییر رنگ
- تغییرات دمایی
- تشکیل موادی با خواص جدید
برای مثال واکنش شیمیایی سوختن یک هیدروکربن را در نظر بگیرید. خروجی این واکنش در حضور اکسیژن کافی، گاز دیاکسید کربن است. پس نشانه اول را داریم. یا سوختن هیدروژن با کلر که تولید هیدروژن کلرید میکند و همراه با آزادسازی گرما و نور بهعنوان دو مشخصه فرآیند احتراق است.
در واکنش قبلی، اگر اکسیژن کافی نباشد و سوختن ناقص انجام شود، تولید خاکستر یا دوده را داریم که نشانه دوم از موارد بالا است. همچنین در واکنش شیمیایی دیگری از نوع ترکیب، واکنش اسید سولفوریک با محلول کلرید باریم تولید رسوب سفید رنگی به نام باریم سولفات میکند که ماده جدیدی است.
نشانه تغییر رنگ معمولا در واکنش محلولها با هم یا واکنش یک جامد و مایع با هم خود را نشان میدهد. مشخصه افزایش دما در واکنشهای شیمیایی گرماده مانند سوختن یکی از مهمترین علامتها است. دقت کنید تمام واکنشهای شیمیایی مثل سوختن گرماده نیستند. در واکنشهای گرماگیر، با دریافت گرما از محیط در حین واکنش، دمای محیط افت میکند.
نکته مهم دیگر مقایسه واکنشها یا تغییرات شیمیایی با تغییرات فیزیکی است. برخلاف تغییرات فیزیکی که شامل تغییر حالت فیزیکی ماده هستند، در تغییرات شیمیایی مولکولهای جدیدی تولید میشوند. برای مثال، ذوب شدن مادهای مثل یخ یا بخار شدن آب تغییرات فیزیکی محسوب میشوند. در این واکنشها با اینکه حالت ماده عوض میشود، اما فرمول شیمیایی آب تغییری نکرده است. اما در تغییر شیمیایی با شکسته شدن یک یا چند پیوند از مواد واکنشدهنده و تشکیل پیوندهای جدید، مواد جدیدی ساخته میشوند.
یادگیری احتراق با فرادرس
پیش از اینکه به ادامه یادگیری بپردازیم و ببینیم انواع احتراق چیست، در این بخش چند فیلم آموزشی کاملا مرتبط با موضوع این مطلب معرفی میکنیم. اگر دانشآموز هستید، مباحثی مانند « تغییرات شیمیایی» و «مثلث سوختن» اولین بار در کتاب علوم تجربی پایه هشتم مطرح میشوند. همچنین در کتاب علوم پایه نهم با «هیدروکربنها» و «انواع سوختهای فسیلی» آشنا میشوید. مشاهده فیلمهای آموزشی زیر از مجموعه فرادرس به شما کمک میکند تا یادگیری این مباحث را قوی شروع کنید:
- فیلم آموزش علوم تجربی هشتم بخش شیمی فرادرس
- فیلم آموزش علوم تجربی نهم بخش شیمی فرادرس
همچنین در مقاطع بالاتر و در کتابهای درسی شیمی دهم و یازدهم مباحث تکمیلی عناوین بالا بیان شده است. اگر دنبال این هستید که با نحوه حل تمرین و سوالات امتحانات نهایی در این زمینه بیشتر آشنا شوید، مشاهده فیلمهای فرادرس به ترتیب زیر به شما کمک خواهد کرد:
- فیلم آموزش شیمی دهم فرادرس
- فیلم آموزش شیمی دهم حل سوالات تشریحی امتحانات نهایی فرادرس
- فیلم آموزش شیمی یازدهم فرادرس
- فیلم آموزش شیمی یازدهم حل سوالات تشریحی امتحانات نهایی فرادرس
انواع احتراق چیست؟
حالا که متوجه شدیم احتراق بهعنوان یک واکنش شیمیایی چه خصوصیاتی دارد، برای اینکه بهتر یاد بگیریم احتراق چیست، لازم است انواع آن را بشناسیم. سوختن یا احتراق به دو صورت ممکن است انجام شود، کامل یا ناقص (ناکامل). در سوختن کامل، تمام واکنش دهندهها در اکسیژن کافی میسوزند و تعداد محدودی محصول تولید میشود. اما در سوختن ناقص، چون اکسیژن کافی فراهم نیست، تمام سوخت مصرف نمیشود و محصولات تولید شده اغلب سمی هستند.

به همین علت است که سوختن کامل را «سوختن تمیز» و سوختن ناقص را «سوختن سمی» مینامند. در سوختن کامل، پس از اینکه تمام عناصر سوختند، محصولات واکنش شامل اکسیدهای معمول است. برای مثال، اگر کربن با اکسیژن ترکیب شود، دیاکسید کربن تولید میشود. در ترکیب گوگرد و گاز اکسیژن، سولفور دیاکسید حاصل میشود یا واکنش آهن و اکسیژن که اکسید آهن (II) تولید میکند. در ادامه خصوصیات و تفاوتهای این دو نوع احتراق را با جزئیات بیشتر توضیح میدهیم.
احتراق کامل چیست؟
در این بخش یاد میگیریم اولین نوع احتراق چیست و چه ویژگیهایی دارد. در احتراق کامل یا سوختن تمیز، اکسیژن کافی برای احتراق موجود است. در نتیجه ماده واکنشدهنده با اکسیژن، بهطور کامل مصرف میشود. معمولا این نوع احتراق در دمای بالا رخ میدهد. اگر ماده واکنشدهنده با اکسیژن در احتراق کامل، یک ترکیب آلی مثل انواع هیدروکربنها باشد، محصولات نهایی آن دیاکسید کربن و آب به شکل بخار است.
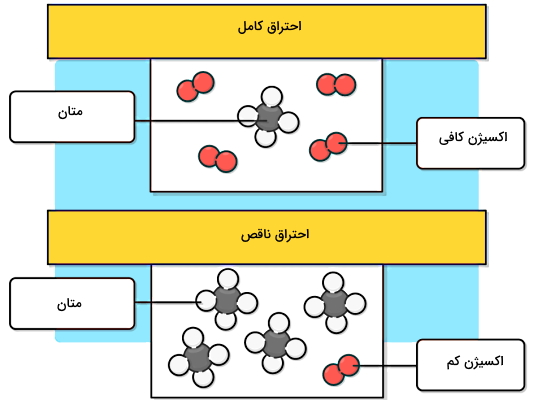
برای مثال، در شکل بالا زمانی که یک مولکول از هیدروکربنی مانند متان در معرض اکسیژن کافی بسوزد، یک مولکول کربن دیاکسید و دو مولکول بخار آب تولید میکند. بنابراین منظورمان از اکسیژن کافی برای این واکنش این است که به ازای هر مولکول متان دو مولکول دو اتمی اکسیژن داشته باشیم. اگر دقت کنید در قسمت پایین این تصویر به ازای چهار مولکول متان فقط یک مولکول اکسیژن وجود دارد. بنابراین این واکنش حتما یک سوختن ناقص است.
یکی دیگر از بهترین مثالها برای سوختن کامل، احتراق کاملی است که نیاز است در موتور ماشین داشته باشیم. البته انجام احتراق کامل در موتور ماشین بهتنهایی امکانپذیر نیست و برای این منظور از مبدلهای کاتالیستی کمک گرفته میشود. با در نظر گرفتن گاز متان بهعنوان سوخت، انتظار داریم واکنش ایدهآل زیر را در موتور ماشین داشته باشیم. اما در واقعیت چنین اتفاقی رخ نمیدهد و احتراق در موتور ماشین کامل نیست.
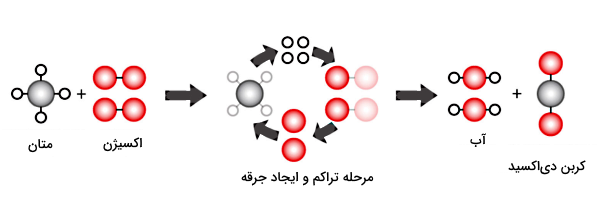
مثال دیگر، آمادهسازی صنعتی تری اکسید گوگرد (SO3) یا «نیسو سولفان» است که نمونهای از فرآیند احتراق کامل در دمای بالا است. این ماده یکی از مهمترین انواع اکسید گوگرد است، چون بهعنوان پیشماده برای ساخت اسید سولفوریک استفاده میشود و آمادسازی آن به این شکل است که دیاکسید گوگرد در دمایی حدود ۴۰۰ تا ۶۰۰ درجه سانتیگراد و به کمک یک کاتالیزور، اکسید میشود.
یکی دیگر از مهمترین مشخصههای احتراق کامل و ناقص این است که در سوختن ناقص رنگ شعله تولید شده زرد است، در حالی که در سوختن کامل رنگ شعله آبی است. اگر به شکل سمت راست در تصویر زیر توجه کنید، با باز گذاشتن حفره هوا در چراغ، اکسیژن کافی به سوخت داخل چراغ خواهد رسید. در نتیجه سوختن کامل داریم که نشانه آن شعلهای آبی رنگ، غیرقابل تحمل و داغ است.
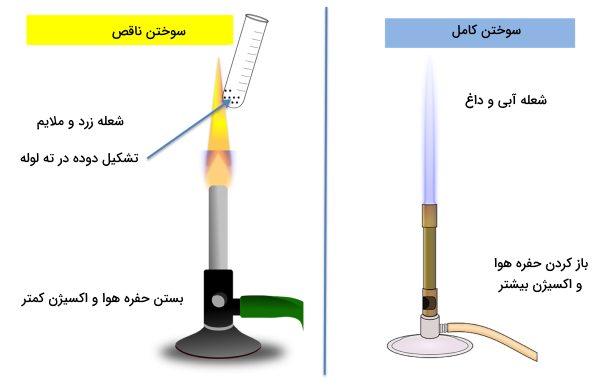
اما در سمت چپ تصویر، با بستن حفره هوا و ممانعت از رسیدن اکسیژن کافی به سوخت داخل چراغ، سوختن ناقص انجام میشود که نتیجه آن شعلهای زرد با گرمای ملایم و قابل تحمل است. همچنین شکل زیر تغییر رنگ شعله را از زمانی که حفره هوا کاملا بسته است (شماره یک – سوختن ناقص)، تا زمانی که حفره هوا کاملا باز شده است (شماره چهار – سوختن کامل) نشان میدهد. در شماره دو و سه با باز شدن تدریجی حفره هوا و دریافت اکسیژن بیشتر، مشاهده میکنید که به تدریج رنگ شعله به سمت آبی تغییر میکند.

اگر بخواهیم مجموعه معادلات کامل برای احتراق هیدروکربن در هوا را بیان کنیم، نیاز است محاسبات بیشتری در مورد نحوه توزیع اکسیژن بین کربن و هیدروژن در ماده سوختنی انجام شود. مقدار هوای لازم برای اینکه واکنش احتراق کامل داشته باشیم، «هوای استوکیومتریک» (Stoichiometric Air) یا «هوای تئوری» (Theoretical Air) نامیده میشود. برای داشتن فرآیند احتراق جزئی، مقدار هوای بیشتر از این مقدار موردنیاز است که به آن «هوای اضافی» (Excess Air) گفته میشود. مقدار هوای اضافی از ۵% برای یک دیگ گاز طبیعی تا ۴۰% برای زغالسنگ آنتراسیت و تا بالای ۳۰۰% برای یک توربین گازی متغیر است.

در انتهای این بخش، خلاصهای از مشخصات یک واکنش احتراق کامل را میتوانیم شامل موارد زیر بدانیم:
- مقدار ماده اکسنده یا اکسید کننده باید به اندازهای باشد که تمام سوخت مصرف شود.
- اگر هیدروکربن بسوزد، محصول تولید شده فقط دیاکسید کربن و بخار آب است.
- رنگ شعله در این نوع سوختن همیشه آبی است.
- دود تولید نمیشود.
- انرژی تولید شده در این فرآیند خیلی زیاد است.
- تنها اثر زیستمحیطی ناشی از این نوع سوختن، گرمایش زمین به علت تولید گاز دیاکسید کربن است.
احتراق ناقص چیست؟
تا اینجا آموختیم که مشخصات اولین نوع احتراق چیست. در این بخش نوع دیگری از احتراق، به نام احتراق یا سوختن ناقص را یاد میگیریم. چنانچه اکسیژن موجود در احتراق برای مصرف تمام واکنشدهنده کافی نباشد، در این صورت سوختن ناقص یا سوختن سمی داریم. همچنین اگر ماده واکنشدهنده دارای ناخالصیهایی باشد که قابلیت اشتعال کامل ندارند، باز هم احتراق ناقص خواهیم داشت. در این نوع احتراق، اگر ماده واکنشدهنده هیدروکربن یا هر نوع ترکیب آلی دیگری باشد، همواره محصولات جانبی شامل دوده، کربن و مونوکسیدکربن خواهند بود.
در شکل بالا همانطور که در بخش احتراق کامل گفتیم، در صورتی که به ازای هر مولکول از هیدروکربنی به نام متان، دو مولکول اکسیژن داشته باشیم، در این صورت احتراق کامل خواهیم داشت. حالا فرض کنید بهجای هیدروکربن متان، از سوخت دیگری به نام «اتان» (Ethane) با فرمول C2H6 استفاده کنیم. اگر مقدار اکسیژنی که برای این واکنش در نظر گرفته شده است تغییری نکند، طبق شکل زیر احتراق ناقص انجام میشود، چون امکان اینکه فقط دیاکسید کربن و آب تشکیل شوند، وجود ندارد.
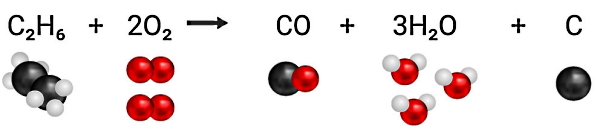
در واکنش بالا چون اکسیژن کافی برای اتان موجود نیست، در نتیجه یکی از اتمهای کربن در آن فقط با یک اتم اکسیژن ترکیب میشود و مونوکسید کربن تولید میشود. سه اتم اکسيژن باقیمانده در این واکنش، با تعداد بالای اتمهای هیدروژن در اتان ترکیب خواهند شد. همچنین یک اتم کربن دیگر هم بدون پیوند باقی میماند که به شکل ذرات دوده یا خاکستر ظاهر خواهد شد.
در مثال موتور ماشین، همانطور که گفتیم آنچه که در واقعیت رخ میدهد، سوختن ناقص است، یعنی علاوه بر دیاکسید کربن و آب، گازهای آلودهای مانند انواع اکسیدهای نیتروژن (NOx)، هیدروکربنهای نسوخته مانند (HC)، مونوکسید کربن و ذرات دوده نیز تولید میشوند. اگر ماده سوختنی خوب با اکسیژن مخلوط نشود نیز ممکن است احتراق ناقص داشته باشیم. اینکه دو نوع احتراق کامل و ناقص داریم به این معنا است که ماده سوختی یا واکنشدهنده میتواند بهصورت کامل یا جزئی با اکسيژن ترکیب شود. دقت کنید همانطور که در احتراق کامل آب تولید میشد، در این نوع احتراق نیز آب تولید میشود. اما بهجای دیاکسید کربن، در سوختن ناقص کربن و مونوکسید کربن تولید میشوند.
در ابتدای مطلب اشاره کردیم که برای بیشتر سوختها مثل زغال، چوب یا گازوئیل، فرآیند پیرولیز یا تجزیه حرارتی پیش از احتراق رخ میدهد. در سوختن ناقص، محصولات تولید شده طی فرآیند پیرولیز نسوخته میمانند. در نتیجه، دود حاصل از احتراق با انواع ذرات و گازهای مضر آلوده خواهد شد. ترکیباتی که کامل اکسید نشدهاند، معمولا نگرانکنندهاند، برای مثال اکسید شدن جزئی اتانول که باعث تولید «استالدهید» (Acetaldehyde) مضر میشود یا کربن که ممکن است گاز مونواکسید کربن سمی را تولید کند.
همانطور که گفتیم، مونوکسید کربن یکی از محصولات تولید شده در احتراق ناقص است. علت تولید این ماده این است که ایجاد این گاز، گرمای کمتری نسبت به تولید کربن دیاکسید ایجاد میکند. به همین دلیل است که دنبال این هستیم تا فرآیند سوختن کامل داشته باشیم و از تولید مونوکسید کربن بیشتر جلوگیری کنیم. خطر مونوکسید کربن این است که از طریق تنفس وارد بدن شده و بهجای اکسیژن با هموگلوبین خون ترکیب میشود. در نتیجه مانع از این میشود که اکسیژن به بخشهای دیگر بدن بخوبی منتقل شود.

در انتها مشخصات یک احتراق ناقص شامل موارد زیر است:
- مقدار ماده اکسنده یا اکسید کننده برای مصرف تمام سوخت کافی نیست.
- اگر هیدروکربن بسوزد، محصول تولید شده مونوکسید کربن و بخار آب است.
- رنگ شعله در این نوع سوختن زرد یا نارنجی است.
- دود تولید میشود.
- انرژی تولید شده در این فرآیند کم است.
- اثر مخرب زیستمحیطی ناشی از این نوع سوختن، آلودگی هوا به علت تولید مونوکسید کربن و دود است.
معادله شیمیایی احتراق
در بخشهای قبل یاد گرفتیم که انواع احتراق چیست و چگونه ایجاد میشوند. در این بخش میخواهیم یک معادله شیمیایی کلی برای احتراق کامل ارائه دهیم که به نوع ماده سوختنی بستگی دارد. اگر ماده سوختنی یک ماده غیرآلی مثل منیزیم باشد، این ماده به آسانی اکسید میشود. اما اگر ماده واکنشدهنده با اکسیژن یک ترکیب آلی باشد، محصولات تولید شده آب و دیاکسید کربن هستند. پس به طور کلی دو نوع معادله برای احتراق کامل داریم:
- در حالت اول یعنی واکنش یک ماده غیرآلی فلز یا نافلز با اکسیژن، معادله مناسب برای واکنش شیمیایی احتراق به شکل زیر است:

در این معادله M یک ماده غیرآلی واکنشدهنده با اکسیژن مانند Mg و MxOy محصول است (اکسیدی مثل MgO):
- در حالت دوم واکنش ماده آلی با اکسیژن را داریم و میتوانیم معادله کلی زیر را برای آن در نظر بگیریم که در آن CxHy یک ماده واکنشدهنده آلی مثل گاز متان است:
در سمت راست معادله بالا، میتوان انرژی گرمایی و نور را هم اضافه کرد. پس میتوانیم نتیجهگیری کنیم که یکی از عوامل دیگری که باعث میشود معادله احتراق متفاوت باشد، نوع ماده سوختنی است. اگر ماده سوختنی یک ترکیب آلی باشد، احتمال تولید دیاکسید کربن و آب وجود دارد. در بخش بعد در مورد اینکه یک ترکیب آلی چیست و چه خصوصیاتی دارد، توضیح میدهیم.
نکته: دقت کنید در جمله بالا از کلمه احتمال استفاده کردیم، چون تولید این دو ماده بهعنوان محصول، به اینکه چقدر اکسیژن در دسترس است، بستگی دارد. بهعبارت دیگر، در یک واکنش احتراق کامل، حتما آب و CO2 تولید میشود. اما اگر اکسیژن کافی نباشد، حتی با وجود ماده آلی در طرف اول معادله، در سمت دیگر معادله دیاکسید کربن نخواهیم داشت.
تعریف ماده آلی
برای اینکه بهتر متوجه شویم نقش ترکیبات آلی بهعنوان سوخت در یک فرآیند احتراق چیست، باید ابتدا تعریف یک «ترکیب آلی» (Organic Compound) را بدانیم. ترکیبات آلی گروه بزرگی از ترکیبات شیمیایی را تشکیل میدهند که در همه آنها یک مشخصه مشترک وجود دارد. در یک ترکیب آلی، همیشه یک یا چند اتم کربن (C) در قالب یک یا چند پیوند کووالانسی به عناصر دیگر متصل شده است. عناصر متصل به کربن معمولا اکسیژن، هیدروژن یا نیتروژن هستند.
-
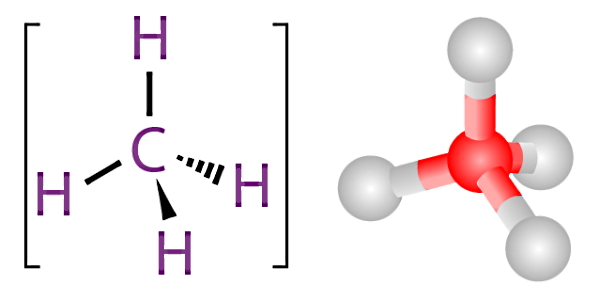
ترکیب شیمیایی مولکول آلی متان (CH4)
پس مشخصه یک ترکیب آلی، داشتن اتم کربن است. اکثر سوختهای معمول مانند چوب، زغالسنگ، نفت و گاز طبیعی، جزء ترکیبات آلی محسوب میشوند. بنابراین دارای پیوند کربنی هستند. پس زمانی که یک ترکیب آلی با اکسیژن واکنش دهد، انتظار داریم بین اکسیژن و کربن پیوند شیمیایی برقرار شود. در این شرایط اگر مقدار اکسيژن کافی باشد، دیاکسید کربن (CO2) تولید میشود. در غیر این صورت، گاز سمی مونوکسید کربن (CO) را بهعنوان محصول احتراق خواهیم داشت.
مثال از احتراق هیدروکربنها
تا اینجا تا حدی متوجه شدیم که احتراق چیست و چه معادلات شیمیایی میتوانند بهخوبی این فرآیند را توصیف کنند. همچنین با خصوصیات انواع واکنشهای شیمیایی نیز در بخشهای قبل آشنا شدیم. در این بخش میخواهیم چند معادله شیمیایی احتراق را بهعنوان چند مثال از این فرآیند با هم بررسی کنیم. قبلا گفته بودیم بیشتر واکنشهای احتراق از سوختن یک هیدروکربن ایجاد میشوند که با تولید انرژی حرارتی بسیار بالایی همراه است. به همین دلیل است که بیشتر هیدروکربنها بهعنوان سوخت کاربرد دارند.
احتراق پروپان (C3H8)
اولین معادلهای که در نظر گرفتیم تا بهتر یاد بگیریم که احتراق چیست، واکنش سوختن «پروپان» (Propane) با فرمول شیمیایی C3H8 است. پروپان یک هیدروکربن گازی شکل است، در نتیجه فقط از اتمهای کربن و هیدروژن ساخته شده است و میدانیم محصول چنین واکنشی باید تولید گاز دیاکسید کربن و آب باشد. معادله شیمیایی احتراق پروپان به شکل زیر است:
همانطور که در معادله بالا مشاهده میکنید، با توجه به ترکیب شیمیایی پروپان، برای اینکه سوختن کامل رخ دهد، لازم است ۵ مولکول اکسیژن با هر یک از مولکولهای پروپان واکنش دهند تا ۳ مولکول CO2 و ۴ مولکول آب تولید شود. از پروپان بهعنوان سوخت معمول در کورههای گازی استفاده میشود.

نکته: دقت کنید در تمام مثالهای سوختن هیدروکربن، معادله شیمیایی برای فرآیند سوختن کامل نوشته شده است. بنابراین در حضور مقدار اکسیژنی کمتر از این مقادیر تعادلی، سوختن ناقص ایجاد میشود و محصول تولید شده مونوکسید کربن خواهد بود. پیدا کردن مقادیر تعادلی با توجه به رابطه کلی زیر که در بخش قبل هم به آن اشاره شد، ممکن است. البته میتوانید با قوانین موازنه هم پیش بروید.
در مورد پروپان، x=۳ و y=۸ است. بنابراین طبق معادله بالا به تعداد x+y/۲=۳+۴/۲=۵ مولکول اکسیژن نیاز داریم تا سوختن کامل داشته باشیم و در بخش محصولات تعداد x=۳ مولکول دیاکسید کربن و y/۲=۸/۲=۴ مولکول آب تولید میشوند. همچنین نمونه دیگری از معادله سوختن پروپان در شکل زیر نشان داده شده است که یک احتراق ناقص است. اگر دقت کنید با اینکه در محصولات واکنش دیاکسید کربن و آب هم داریم، اما مونوکسید کربن و دوده هم تشکیل شده است که نشان میدهد احتراق کامل نیست.
احتراق متان (CH4)
سادهترین هیدروکربنی که میتوانیم در نظر بگیریم، گاز «متان» (Methane) با فرمول شیمیایی CH4 است. معادله شیمیایی که سوختن کامل متان را توصیف میکند، به شکل زیر است:
گازوئیل
احتراق اتانول (C2H5OH)
در ادامه میخواهیم ببینیم سایر مثالهای احتراق چیست. احتراق درچراغهای الکلی هم اتفاق میافتد، به این شکل که در این چراغها «اتانول» (Ethanol) مایع با ترکیب شیمیایی C2H5OH با قرار گرفتن در معرض گاز اکسیژن، بهعنوان سوخت اصلی در احتراق مصرف میشود. دقت کنید اتانول در این مثال هنگام سوختن در حالت مایع است. معادله شیمیایی تعادلی سوختن اتانول بهصورت زیر است:
همانطور که مشاهده میکنید محصول این واکنش هم دیاکسید کربن و آب است، چون اتانول هم یک هیدروکربن محسوب میشود. با اینکه اتانول هنگام سوختن در حالت مایع است، اما آب تولید شده بهعنوان محصول سوختن در حالت گاز یا بخار است. علت این مسئله دمای بالای واکنش سوختن است که باعث میشود آب تبخیر شود.
احتراق نفتالین (C10H8)
یکی دیگر از انواع هیدروکربنهای معمول در احتراق، «نفتالین» (Naphthalene) با فرمول شیمیایی C10H8 است. نفتالین هم اگر در معرض اکسیژن کافی (به ازای هر مولکول نفتالین ۱۲ مولکول اکسیژن نیاز است) قرار بگیرد، یک واکنش شیمیایی سوختن کامل ایجاد میشود که نتیجه آن، تولید گاز دیاکسید کربن و بخار آب است:
سوختن نفتالین هم یک فرآیند گرماده است، بنابراین در طرف دوم معادله بالا گرما نیز یکی از محصولات واکنش است.
نکته ۱: در تمامی معادلاتی که به عنوان مثالهای احتراق تا اینجا توضیح دادیم، همواره دو طرف معادله شیمیایی در موازنهاند. برای مثال در سمت چپ معادله بالا یا در بخش واکنشدهندهها اگر تعداد اتمهای کربن، هیدروژن و اکسیژن را بشمارید، تعداد ۱۰ اتم کربن، ۸ اتم هیدروژن و ۲۴ اتم اکسیژن داریم. در طرف راست یا بخش محصولات این معادله نیز باید تعداد این اتمها همین مقدار باشد.
نکته ۲: احتمالا تا اینجا متوجه شدهاید که هیدروکربنهای مختلف نسبتهای متفاوتی از کربن و هیدروژن دارند. در نتیجه نسبت بخار آب به دیاکسید کربن تولید شده در سوختن آنها با هم فرق دارد. برای مثال در سوختن نفتالین نسبت این دو محصول به هم ۴ به ۱۰ است، در حالی که در سوختن اتانول این نسبت ۳ به ۲ است.
احتراق بنزین (C8H18)
تا اینجا آموختیم مثالهای مختلف احتراق چیست. بهعنوان آخرین مثال از این بخش، معادله شیمیایی سوختن یک هیدروکربن آشنا به نام بنزین را بررسی میکنیم. «بنزین» (Gasoline) یا «اکتان» (Octane) با فرمول شیمیایی C8H18 به شکل زیر در حضور اکسيژن کافی میسوزد:
در همین زمینه اگر کنجکاو هستید در مورد «عدد اکتان» و ارتباط آن با کیفیت عملکرد بنزین اطلاعات بیشتری کسب کنید، میتوانید مطلب «اعداد اکتان و ستان چه تفاوتی با یکدیگر دارند؟ — به زبان ساده» از مجله فرادرس را مطالعه کنید.
مثال از احتراق فلزها و نافلزها
در بخش قبل مثالهایی از سوختن هیدروکربنهای مختلف را بررسی کردیم. همانطور که در بخش معادله شیمیایی احتراق بیان شد، در حالت کلی بسته به نوع ماده واکنشدهندهای که میسوزد، محصولات احتراق متفاوت هستند. برای هیدروکربنها در حضور اکسيژن کافی، همیشه دیاکسید کربن و بخار آب تولید میشود. اما برای عناصر یا ترکیبات فلزی یا نافلزی غیرآلی مانند عنصر منیزیم، گوگرد یا کربن، واکنش با اکسیژن فقط موجب میشود بخار اکسید آن عنصر حاصل شود. در ادامه چند مثال را در این زمینه با هم بررسی میکنیم.
احتراق گاز هیدروژن
یکی دیگر از مثالهای احتراق، واکنش گاز هیدروژن با گاز اکسیژن و تشکیل بخار آب است. شاید واکنش اکسیژن و هیدروژن گازی بهعنوان یک فرآیند احتراق دور از ذهن بهنظر برسد، اما واقعیت این است که این واکنش نوعی احتراق است و معادله شیمیایی آن بهصورت زیر است:
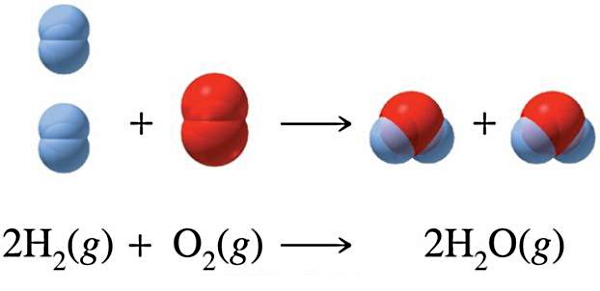
در طرف دوم این معادله گرما هم وجود دارد. احتراق واکنشی است که در آن مادهای با گاز اکسیژن وارد یک واکنش شیمیایی میشود و در نتیجه، انرژی در قالب گرما و نور آزاد میشود. پس یکی از مولفههای اساسی در احتراق این است که گاز اکسیژن را بهعنوان یکی از واکنشدهندهها حتما داشته باشیم. در معادله بالا این نکته رعایت شده است.
یکی از وقایع ناگواری که بر اثر احتراق گاز هیدروژن ایجاد شد، سانحه «کشتی هوایی هیندنبورگ» (Hindenberg Airship) است. یک کشتی هوایی پر شده با هیدروژن گازی که در هنگام فرود خود دچار سانحه و برخورد با یک دکل شد. در نتیجه این سانحه، احتراق هیدروژن بهطور ناگهانی به شکل یک گلوله آتشین عظیم شروع شد. انرژی ناشی از این احتراق به حدی بود که باعث شد کشتی و تعدادی از انسانها جان خود را از دست بدهند. این سانحه در نتیجه معادله ساده بالا و واکنش هیدروژن گازی با اکسیژن رخ داد.
سوختن کربن
یکی دیگر از واکنشهای سوختن، سوختن کربن (C) است. خود اتم کربن یک هیدروکربن محسوب نمیشود. پس انتظار نداریم از سوختن کربن تنها، هر دو محصول دیاکسید کربن و بخار آب حاصل شود. اما بسته یه میزان اکسیژنی که در دسترس است، سوختن کربن میتواند باعث تولید گاز دیاکسید کربن تنها یا مونوکسید کربن تنها شود:
سوختن گوگرد
در ادامه یادگیری مبحث احتراق چیست، معادله احتراق دیگری را با هم بررسی میکنیم که باز هم ترکیب یک ماده غیرآلی به نام گوگرد (S) با اکسیژن است و نتیجه آن، تشکیل اکسیدی از آن ماده است:

سوختن منیزیم
در ادامه بررسی چند مثال از احتراق مواد غیرآلی یا موادی که در گروه هیدروکربنها قرار نمیگیرند، عنصر منیزیم با نماد شیمیایی Mg نیز در حضور اکسیژن واکنش شیمیایی احتراق را ایجاد خواهد کرد که محصول آن اکسید منیزیم است:
احتراق گاز نیتروژن
آخرین معادله شیمیایی که در این قسمت بررسی میکنیم تا بهتر یاد بگیریم که احتراق چیست، سوختن نیتروژن است. نیتروژن گازی در حضور گاز اکسيژن به دو شکل میتواند واکنش شیمیایی احتراق را ایجاد کند:
انواع دیگر احتراق چیست؟
احتراق یکی از چند نوع واکنش شیمیایی اصلی محسوب میشود که خود این فرآیند را میتوان به شکلهای مختلفی تقسیمبندی کرد. در تمام فرآیندهای احتراق، گاز اکسیژن به شکل یک مولکول دو اتمی حضور دارد. برای شروع هر نوع احتراقی، دمای بالا یا یک جرقه کافی است. سپس اکسیژن میتواند با یک عنصر یا یک ماده ترکیب واکنش دهد و با آن ترکیب شود. این ماده ترکیب میتواند آلی یا غیرآلی باشد.

در احتراق همیشه علاوه بر محصولات شیمیایی مختلف، گرما و نور نیز بهعنوان محصول جانبی تولید میشوند. بر اساس انرژی و سرعت واکنش، میتوانیم احتراق را به چند دسته دیگر نیز تقسیمبندی کنیم:
- احتراق سریع
- احتراق دودهای
- احتراق خود به خودی
- احتراق آشفته
- احتراق میکروگرانشی
پس علاوه بر سوختن کامل و ناقص، تقسیمبندی دیگری از انواع سوختن وجود دارد که در این بخش به بیان خصوصیات آنها خواهیم پرداخت.
احتراق سریع
همانگونه که از اسم این نوع سوختن مشخص است، در احتراق سریع سرعت انجام واکنش سریع است. چنین واکنشی مقدار زیادی گرما و نور تولید میکند و میتواند منجر به آتشسوزی یا انفجار شود. معمولا موتور ماشینها و موتورهای داخلی احتراقی در سایر دستگاهها طوری تنظیم میشوند که احتراق سریع سوختهای فسیلی اتفاق بیفتد.
احتراق با دود
این نوع احتراق ناقص، یک فرآیند بسیار آهسته و کند در دمای پایین است. برخلاف احتراق سریع، در این نوع فرآیند شعلهای تولید نمیشود و دمای نسبتا پایینی دارد. در این احتراق سطح ماده سوختنی برای مثال چوب، به کندی با اکسیژن واکنش میدهد. یکی از مشخصات این نوع احتراق، نوعی درخشش پایدار است که در آتش در حال خاموش شدن قابل مشاهده است.معمولا سوختهایی که دارای خلل و فرجهای فراوان هستند، چنین احتراقی ایجاد میکنند.

احتراق خود به خودی
تا اینجا یاد گرفتیم برخی انواع دیگر احتراق چیست. برای خیلی از مواد فرار مانند هیدروکربنها قابلیت احتراق بدون کمک گرفتن از شعله یا جرقه بهعنوان عامل محرک، وجود دارد. اصولا ترکیبات فرار دارای فشار بخار بالای و دمای آتش گرفتن پایینی هستند. اگر این مواد داخل یک محفظه قرار بگیرند، گرما و فشار باعث میشود احتراق خود به خودی برای آنها اتفاق بیفتد. همچنین برخی از انواع زغالسنگ نیز اگر در معرض اکسیژن بالایی قرار بگیرند، دچار احتراق خود به خودی خواهند شد.
احتراق آشفته
این نوع از احتراق یک نمونه عملی از سوختن است که در موتورها و توربینهای گازی بکار میرود. چنین احتراقی به بهبود بازدهی واکنشهای بین اکسیژن و سوخت کمک میکند.
احتراق میکروگرانشی
این شکل از سوختن کاملا با انواع دیگر احتراق که روی زمین اتفاق میافتند، متفاوت است. در ایستگاههای فضایی آزمایشهایی جهت مشاهده رفتار شعله در حال انجام است. طبق نتایج این آزمایشها، با توجه به گرانش ضعیف، شعلهها در خارج از زمین شکل کروی به خود میگیرند. در شکل زیر تفاوت شعله روی زمین با شعله در فضایی با گرانش ضعیف یا میکروگرانش مشخص است.

اثر نیتروژن هوا در احتراق
در بخش قبل کاملا یاد گرفتیم که انواع احتراق چیست و بر چه اساسی میتوانیم تقسیمبندیهای مختلفی از احتراق داشته باشیم. در این بخش میخواهیم توضیح دهیم با توجه به اینکه هوا علاوه بر اکسیژن، از نیتروژن هم تشکیل شده است، اثر نیتروژن در احتراق چیست؟ همچنین با توجه به اینکه در ترکیبات سوختهای فسیلی عنصر نیتروژن وجود ندارد، سوالی که مطرح میشود این است که در فرآیند سوختن آنها، چگونه اکسید نیتروژن شکل میگیرد؟
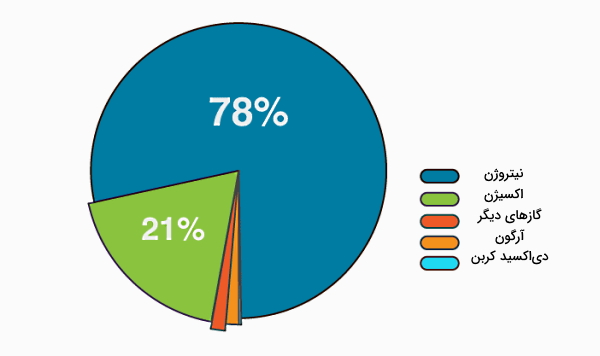
برای اینکه به این سوالات پاسخ دهیم، ابتدا بهتر است بررسی کنیم هوا از چه عناصری تشکیل شده است. هوای اطراف ما تقریبا از ۲۱% گاز اکسیژن و ۷۸% گاز نیتروژن تشکیل شده است. در شرایط معمول، اکسیژن و نیتروژن با هم واکنشی نمیدهند. در بیشتر کاربردهای صنعتی و در تولید آتش به هر شکلی، هوا منبع اکسیژن (O2) است. در هوا، هر مول اکسیژن با تقریبا ۳٫۷۱ mol نیتروژن مخلوط میشود. اما این نیتروژن در دماهای معمول در احتراق شرکت نمیکند.
فقط در دماهای خیلی بالاتر، مقداری از این نیتروژن به NOx تبدیل خواهد شد (بیشتر به NO و مقدار خیلی کمی NO2). گونههایی از NOx در دماهایی بالاتر از ۱۵۴۰ C ظاهر میشوند و در دماهای بالاتر نیز، مقادیر بیشتری از این ترکیبات دیده خواهد شد. البته مقدار NOx تولید شده تابعی از اکسیژن اضافی هم هست.
دقت کنید زمانی که اکسیژن بهعنوان اکسید کننده در احتراق است، نیتروژن ماده سوختنی در نظر گرفته نمیشود. اما زمانی که هوا اکسید کننده است، همچنان مقادیر کمی از اکسیدهای نیتروژن (NOx) تولید میشوند. پس اگر احتراقی در دمای بالا و در حضور هوای شامل ۷۸% نیتروژن انجام شود، احتمالا مقدار کمی از مخلوط چند اکسید نیتروژن که NOx نامیده میشوند، تولید خواهد شد. علت این پدیده این است که از نظر ترمودینامیکی دمای بالا فاکتور مطلوبی برای سوختن نیتروژن است.
کاربردهای احتراق
پس از اینکه یاد گرفتیم جنبههای مختلف احتراق چیست، در این بخش به بررسی این مبحث میپردازیم که کاربردهای احتراق چیست. احتراق یا سوختن اولین واکنش شیمیایی کشف شده توسط بشر محسوب میشود که توانست آن را کنترل کند و از آن برای تولید انرژی استفاده کند.
با توجه به اینکه در طبیعت امکان تولید آتش به روش طبیعی وجود دارد (برای مثال شعلههای ناشی از برخورد رعد و برق یا آتش ناشی از مواد آتشفشانی)، این مسئله در عین حال که خطرناک است، در صورت کنترل شدن میتواند یکی از مزیتهای این واکنش نیز محسوب شود.

یکی از روشهای بهبود بخشیدن به فرآیند احتراق، نحوه طراحی وسایل مربوط به آن مثل موتور احتراق داخلی است. راه دیگر بکار بردن دستگاههای پسسوز کاتالیزی مانند مبدلهای کاتالیستی است. عموما احتراق کاتالیزه شده نیست، اما میتوان احتراق را با استفاده از پلاتین یا وانادیوم کاتالیزه کرد. همچنین میتوان روندی را طراحی کرد که در آن گازهای خروجی را به فرآیند احتراق بازگرداند. در واقع باید از این وسایل و دستگاهها در زنجیره محیط زیستی ماشینها در کشورهای زیادی استفاده شود.
بنابراین احتراق کنترل شده بسیار سودمند است و برای پخت غذا، گرمایش خانگی یا صنعتی، تامین توان در صنایع، تولید الکتریسیته یا برق، سفر به جاهای مختلف و ایجاد روشنایی استفاده میشود. در واقع این انرژی گرمایی تولید شده ناشی از احتراق هر سوخت فسیلی مثل زغال، نفت یا سوختهای تجدیدپذیر مانند هیزم است که کاربردهای متنوعی دارد.
همچنین یکی دیگر از مهمترین کاربردهای احتراق این است که در حال حاضر این واکنش بهعنوان تنها منبع تولید توان در موشکها محسوب میشود. به علاوه برای تخریب یا سوزاندن زباله نیز از احتراق یا سوختن استفاده میشود.
آثار احتراق
در آخرین مبحث از این مطلب میخواهیم ببینیم آثار احتراق چیست. زمانی که سوختهای فسیلی میسوزند، دما بالا میرود و همین دمای بالا است که باعث میشود نیتروژن با اکسیژن واکنش دهد و گازهای اکسید نیتروژن شامل مونوکسید نیتروژن (NO) و دیاکسید نیتروژن (NO2) تشکیل شوند. فرار این گازها به سمت اتمسفر در شکلگیری باران اسیدی موثر است که همراه با آثار مخرب محیطزیستی است. البته درجه احتراق توسط برخی تجهیزات سنجش قابل اندازهگیری و کنترل است.

علاوه بر مشکلات ناشی از سوختن نیتروژن، مشکلات سوختن ناقص را هم داریم. اگر بخواهیم مشکلاتی که در اثر سوختن ناقص ایجاد میشود را دستهبندی کنیم، میتوانیم به موارد زیر اشاره کنیم:
- مشکلات محیطزیستی
- مشکلات سلامتی
آثار محیطزیستی مخرب ناشی از سوختن ناقص سوختهای فسیلی شامل موارد زیر است:
- تشکیل دیاکسید گوگرد و اکسیدهای نیتروژن که باعث تشکیل باران اسیدی میشوند.
- ذرات کربن جامد که موجب کاهش جهانی تابش نور خورسید خواهد شد.
- تشکیل گاز سمی و بیرنگ مونوکسید کربن که باعث کاهش اکسیژن بدن میشود.
بنابراین مهم است که فرآیند سوختن در وسایل گرمایشی یا آشپزی منزل حتما چک شوند. با توجه به تفاوت نشانههای ظاهری شعله در سوختن کامل و ناقص، احتمالا خودتان بتوانید با نگاه به شعله اجاق گاز یا بخاری گازی متوجه شوید آیا سوختن سمی است یا نه.
تکمیل یادگیری احتراق با فرادرس
پس از اینکه کاملا یاد گرفتیم احتراق چیست و چه ویژگیهایی دارد، در این بخش میخواهیم چند فیلم آموزشی کاربردی در مورد احتراق که با رشته مهندسی مکانیک مرتبط است را به شما معرفی کنیم. اما پیش از آن پیشنهاد میکنیم ابتدا با تماشای مجموعه فیلمهای «شیمی عمومی و شیمی آلی» فرادرس، اطلاعات خود را در مورد خصوصیات انواع واکنشهای شیمیایی، موازنه، نحوه شناسایی ترکیبات آلی و چگونگی احتراق آنها تکمیل کنید.
- فیلم آموزش رایگان آشنایی با انواع تغییرات شیمیایی فرادرس
- فیلم آموزش شیمی عمومی فرادرس
- فیلم آموزش شیمی عمومی ۲ فرادرس
- فیلم آموزش شیمی عمومی ۱ و ۲ مرور و حل مساله فرادرس
- فیلم آموزش شیمی آلی ۱ فرادرس
- فیلم آموزش سوخت و احتراق Fuels and Combustion مقدماتی فرادرس
- فیلم آموزش سوخت و احتراق Fuels and Combustion تکمیلی فرادرس
آزمون احتراق
در انتهای این مطلب از مجله فرادرس، پس از اینکه کاملا یاد گرفتید احتراق چیست و چه انواعی دارد، در این قسمت میتوانید با پاسخدهی به سوالات چهار گزینهای زیر میزان یادگیری خود را بیازمایید. در انتهای آزمون، با کلیک روی بخش «دریافت نتیجه آزمون» نمره نهایی شما قابل مشاهده است.
علت اینکه با ریختن مقداری شن روی یک ماده در حال سوختن، آتش خاموش میشود این است که …
دمای اشتعال پایین میرود.
از دریافت اکسیژن جلوگیری میشود.
شن مانعی در مقابل هدایت گرما است.
تمام موارد بالا درست هستند.
گزینه دوم صحیح است. زمانی که مقداری شن روی آتش بریزید، در واقع مانع از این میشوید که اکسیژن به سوخت برسد. میدانیم هوا یا اکسيژن یکی از سه ضلع اصلی مثلث فرآیند احتراق است که بدون آن، آتش خاموش میشود.
محصول احتراق گاز هیدروژن کدام گزینه است؟
دیاکسید کربن
مونوکسید کربن
گزینه سوم درست است. سوختن یا احتراق هیدروژن همان ترکیب این گاز با اکسیژن است. ترکیب این دو طبق معادله زیر، بخار آب تولید میکند.
کدام گزینه از سوختن کامل یک هیدروکربن تولید نمیشود؟
اکسید نیتروژن
دیاکسید کربن
گزینه اول درست است. سوختن کامل هیدروکربن باعث میشود گاز دیاکسید کربن و بخار آب به همراه گرما و نور تولید شود.
سوخت مادهای است که وقتی میسوزد، …
دیکسید کربن تولید میکند.
با هیدروژن ترکیب میشود.
گرما آزاد میکند.
گزینه سوم درست است. سوال در حالت کلی پرسیده شده است و دقیقا نمیدانیم چه نوع سوختی مد نظر است. پس نمیتوانیم بگوییم آیا دیاکسید کربن تولید میشود یا نه.
در مورد ترکیب با هیدروژن و تغییر رنگ به سیاه هم نمیتوان دقیقا نظر داد. تنها گزینهای که از آن در مورد واکنش سوختن مطمئن هستیم، تولید گرما است.
یک هیدروکربن مادهای است که از اتمهای … و … ساخته شده است.
کربن – هیدروژن
اکسیژن – هیدروژن
هیدروژن – نیتروژن
گزینه دوم درست است. فرمول شیمیایی یک هیدروکربن بهصورت CxHy است، به این معنا که این ترکیبات آلی از اتمهای هیدروژن و کربن با نسبتهای مختلف ساخته شدهاند.
برای اینکه احتراق کامل داشته باشیم، جای خالی در معادله شیمیایی زیر کدام گزینه است؟
گزینه اول صحیح است. معادله بالا، سوختن کامل گاز متان است. انتظار داریم محصولات واکنش بخار آب و دیاکسید کربن باشند. پس گزینه سه و چهار اشتباه است. اما برای اینکه توازن در معادله برقرار شود، لازم است دو مولکول آب تولید شود. پس گزینه دوم هم اشتباه است.
فرآیند احتراق اتان در حضور دو مولکول دو اتمی اکسیژن چه نوع سوختنی محسوب میشود؟
نمیتوان مشخص کرد.
گزینه دوم درست است. در بخش احتراق ناقص در مورد این واکنش صحبت کردیم. اگر معادله شیمیایی آن را بنویسیم، با توجه به اینکه اکسیژن کافی برای مصرف تمام اتمهای کربن در اتان (دو اتم کربن) وجود ندارد، لذا سوختن ناقص است و محصولاتی مانند مونوکسید کربن و دوده تولید خواهد شد.
اگر در واکنش سوختن هیدروکربنی به نام گاز «بوتان» (Butane) با فرمول شیمیایی ، به ازای هر 2 مولکول سوخت، 13 مولکول دو اتمی اکسیژن داشته باشیم، آیا سوختن کامل است؟
نمیتوان مشخص کرد.
به میزان نیتروژن در هوا بستگی دارد.
گزینه دوم صحیح است. برای اینکه بتوانیم تشخیص دهیم آیا سوختن کامل انجام میشود یا نه، باید معادله شیمیایی واکنش را بنویسیم. ترکیب 2 مولکول بوتان با فرمولی که در صورت سوال داده شده است، با 13 مولکول دو اتمی اکسیژن در سمت واکنشدهندهها در معادله قرار میگیرد:
در سمت محصولات انتظار داریم برای داشتن احتراق کامل، حتما دیاکسید کربن با فرمول و بخار آب با فرمول تشکیل شوند. پس خواهیم داشت:
علامت سوال به این علت قرار داده شده است که باید معادله موازنه شود. پس از موازنه کردن میبینیم که محصولات دیاکسید کربن و آب با نسبتهای زیر تشکیل میشوند. پس سوختن کامل است.
احتراق یک واکنش … و … است که در نوع کامل آن انرژی … نسبت به نوع ناقص آزاد میشود.
فیزیکی – گرمازا – بیشتری
شیمیایی – گرماگیر – کمتری
شیمیایی – گرمازا – بیشتری
فیزیکی – گرماگیر – کمتری
گزینه سوم درست است. احتراق یک واکنش شیمیایی است، چون در آن محصولات جدیدی تولید میشوند که خواص متفاوتی با مواد واکنش دهنده دارند. همچنین در این فرآیند علاوهبر محصولات اصلی، محصولات جانبی مثل گرما و نور هم تولید میشوند.
پس احتراق گرمازا است. همچنین گرمایی که در احتراق کامل آزاد میشود، از گرمای آزاده شده در احتراق ناقص بیشتر است.
در واکنش احتراق … زیر، مقدار علامت سوال برابر با … است.
گزینه دوم درست است. با توجه به اینکه محصول واکنش احتراق مونوکسید کربن است، پس احتراق ناقص داریم. همچنین برای موازنه با توجه به نسبتهای مواد واکنش دهنده و مقدار آب تولید شده، باید یک مولکول مونوکسید کربن بهعنوان محصول تولید شده باشد.
source