اگر گازی بدون عبور از حالت مایع مستقیم به جامد تبدیل شود، میگوییم تغییر حالت «چگالش برای ماده اتفاق افتاده است. در مطالب قبلی مجله فرادرس با فرآیند تغییر حالت «تصعید» (Sublimation) آشنا شدیم «چگالش»(Desublimation)، دقیقا عکس فرآیند تغییر حالت تصعید محسوب میشود. در این مطلب ابتدا بیان میکنیم که چگالش چیست و با توجه به «نمودار فازی» (Phase Diagram)، چه تفاوتهایی با تصعید یا سایر تغییر حالتهای ماده دارد. سپس با توضیح مثالهایی از چگالش و کاربرد آن در صنعت، با این نوع تغییر حالت در ماده بیشتر آشنا خواهیم شد.

چگالش چیست؟
چگالش یکی از انواع تغییر حالتهای ماده است که در آن ماده بهصورت مستقیم از حالت گاز به حالت جامد تبدیل میشود، بدون اینکه از حالت مایع عبور کند. چگالش دقیقا عکس فرآیند تغییر حالت تصعید یا تبدیل مستقیم ماده از جامد به گاز است. بر همین اساس چگالش را در لاتین Desublimation هم مینامند. این تغییر حالت ماده در روشهای لایهنشانی از گاز بر اساس تشکیل یک رسوب جامد روی سطح، کاربرد زیادی دارد و به همین علت، نام دیگر این فرآیند «رسوب» (Deposition) است. چگالش یک فرآیند فیزیکی گرماده محسوب میشود.
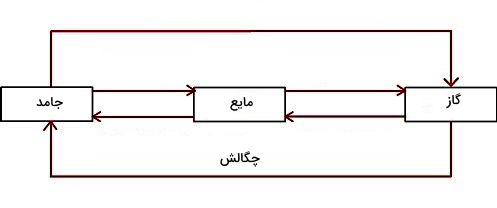
در شکل بالا انواع تغییر حالتهای ماده بهصورت پیکانهای مختلفی برای سه حالت ماده یعنی جامد، مایع و گاز نمایش داده شده است. تغییر حالتهای بین دو فاز مایع و جامد عبارتاند از ذوب و انجماد، تغییر حالتهای بین دو فاز مایع و گاز شامل تبخیر و میعان است و برای تبدیل مستقیم جامد به گاز و برعکس، تغییر حالتهای تصعید و چگالش را داریم. همانطور که در شکل مشخص است، چگالش تغییر حالت مستقیم گاز به جامد است که در این مطلب به این فرآیند خواهیم پرداخت.
عامل مهمی که باعث تغییر حالت در ماده میشود، دما است. در کنار دما، برای برخی تغییر حالتها از جمله چگالش و تصعید، اثر فشار نیز بسیار مهم است. برای اینکه اثر دما و فشار را روی تغییر حالتهای مواد مختلف بررسی کنیم، میتوانیم از نمودار فازی استفاده کنیم. نمودار فازی اطلاعات خیلی مهم و جالبی در مورد دما و فشار لازم برای ایجاد یک تغییر حالت خاص مثل چگالش را به ما میدهد.

برای مثال اگر به شکل بالا دقت کنید، با افزایش دما یا گرم کردن از سمت چپ به راست تصویر، جامد به مایع تبدیل میشود (تغییر حالت ذوب). به این صورت که با افزایش دما، نیروهای جاذبه بینمولکولی برای جامد کاهش خواهند یافت و در نتیجه، انرژی جنبشی مولکولهای جامد زیاد میشود و میتوانند مثل مولکولهای یک مایع آزادانه حرکت کنند. همینجا میتوانیم نتیجهگیری کنیم که اگر بخواهیم ماده از گاز به جامد تبدیل شود، لازم است دما کم شود.
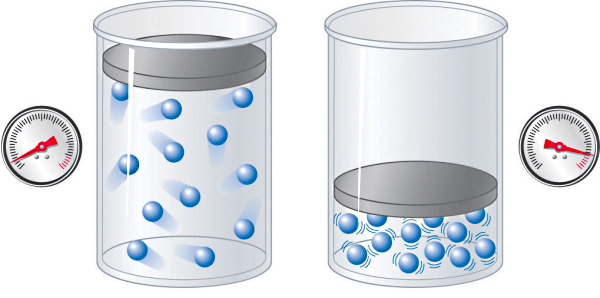
بهعلاوه برای اینکه چگالش رخ دهد، همزمان با کاهش دما باید نیروهای جاذبه بین ذرات تشکیلدهنده گاز آنقدر زیاد شوند که این ذارت مانند ذرات یک جامد در کنار هم با فواصل خیلی کوتاه و نیروهای بینمولکولی قوی قرار بگیرند. برای رسیدن به این هدف، لازم است فشار هم زیاد شود. در شکل بالا، نحوه اعمال فشار روی ذرات یک گاز نشان داده شده است.
در بخشهای بعدی، در مورد شرایط لازم برای رخ دادن تغییر حالت چگالش بیشتر صحبت میکنیم. اما ابتدا با ویژگیهای سه حالت ماده آشنا میشویم تا ببینیم تبدیل مستقیم گاز به جامد باعث میشود خصوصیات ماده چگونه تغییر کند. سپس به بررسی تغییر حالتهای ماده و اینکه چگالش در کدام گروه از این تغییر حالتها قرار میگیرد، خواهیم پرداخت.
یادگیری چگالش با فرادرس
در بخش قبل تا حدودی متوجه شدیم چگالش چیست. اگر دانشآموز هستید، میتوانید برای یادگیری بهتر مطالب بیان شده در این مطلب از فیلمهای آموزشی زیر در مجموعه فرادرس استفاده کنید:
- فیلم آموزش علوم هشتم بخش شیمی فرادرس
- فیلم آموزش فیزیک پایه دهم فرادرس
- فیلم آموزش فیزیک دهم – مرور و حل تمرین فرادرس
- فیلم آموزش رایگان دما و گرما در فیزیک پایه دهم فرادرس
انواع حالتهای ماده چیست؟
برای اینکه بهتر یاد بگیریم چگالش چیست، لازم است ابتدا حالتهای ماده در ابتدا و انتهای این فرآیند و ویژگیهای هر کدام را بهخوبی بشناسیم. در فیلم آموزشی فیزیک پایه دهم فرادرس میتوانید اطلاعات خیلی خوبی در مورد مباحث دما و گرما و انوع تغییر حالتهای ماده بهدست آورید. لینک این فیلم در ادامه قرار داده شده است:
میدانیم هر چیزی که دارای جرم و حجم باشد، ماده نامیده میشود. همچنین، تمام مواد اطراف ما در یک دما و فشار مشخص فقط در یکی از سه حالت ماده یعنی جامد، مایع یا گاز قرار دارند. در چگالش، ماده از حالت گاز به جامد تبدیل میشود، بدون اینکه از فاز میانی مایع عبور کرده باشد.
درک بهتر این جمله و اینکه چرا انتظار داریم در چگالش ماده ابتدا وارد حالت مایع شود و سپس به جامد تبدیل شود، مستلزم این است که ویژگیهای هر حالت از ماده را بدانیم. البته ذکر این نکته ضروری است که بهجز این سه حالت، برای ماده حالت دیگری به نام «پلاسما» (Plasma) هم شناسایی شده است که در موارد محدودی ایجاد میشود و موضوع این مطلب نیست. چنانچه تمایل دارید اطلاعات بیشتری در مورد حالت چهارم ماده کسب کنید، میتوانید مطلب «پلاسما در فیزیک — به زبان ساده» از مجله فرادرس را مطالعه کنید.
ویژگیهای حالت جامد چیست؟
ابتدا میخواهیم ببینیم خصوصیات ماده در انتهای فرآیند تغییر حالت چگالش چیست. خروجی چگالش، حالت جامد ماده است. در یک «جامد» (Solid)، ذرات شامل اتمها یا مولکولهای تشکیلدهنده ماده انرژی لازم برای غلبه بر نیروهای بینمولکولی قوی بین هم را ندارند. در واقع این ذارت فقط در جای خود نوسان کوچکی به جلو و عقب دارند و در کنار هم با فواصل خیلی کوتاهی قرار میگیرند، طوری که ساختار نهایی ماده یک شبکه محکم و سخت است با شکل و حجم مشخص و تعریف شدهای.
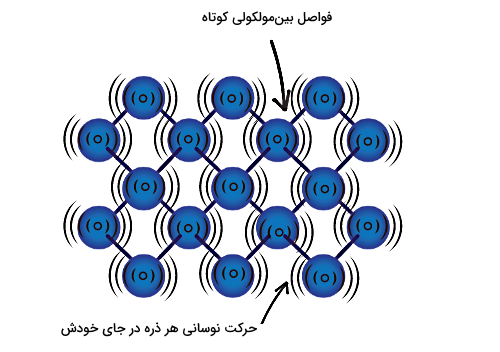
اینکه ذرات سازنده جامد نمیتوانند آزادانه حرکت کنند، باعث میشود این حالت از ماده نه تنها مثل مایعات یا گازها قابلیت جاری شدن یا سیال بودن را نداشته باشد، بلکه کاملا مستحکم و سخت باشد. بنابراین قابلیت تراکمپذیری جامدات خیلی کم است و در مقایسه با مایعاتو بهخصوص گازها دارای چگالی بالایی نیز هستند.

عناصر زیادی مثل سدیم (Na)، وانادیوم (V) و منیزیم (Mg) در دمای اتاق در حالت جامد قرار دارند، . جامدات زیادی هم به صورت ترکیبی از چند عنصراند. برخی از این ترکیبات دارای شکل هندسی منظم و بلورین هستند، مثل نمک طعام (NaCl) و برخی بیشکل یا آمورف محسوب میشوند مثل شیشه یا پلاستیک.
ویژگیهای حالت مایع چیست؟
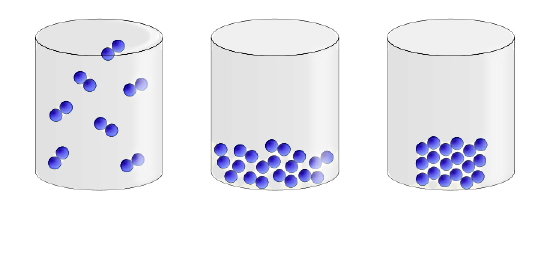
پس از اینکه آموختیم خصوصیات ماده در انتهای فرآیند چگالش چیست، در این قسمت ویژگیهای حالت مایع را بررسی میکنیم. نیروهای بینمولکولی بین ذرات تشکیلدهنده یک مایع آنقدری قوی هست که حجم تعریفشدهای برای مایع ایجاد کند. در عین حال اندازه این نیروها در حدی قوی نیست که شکل تعریف شدهای هم به مایع بدهد. تصویر زیر تفاوت ذرات تشکیلدهنده مایع (شکل وسط) را با ذرات تشکیلدهنده جامد (شکل سمت چپ) و گاز (شکل سمت راست) نشان داده است.
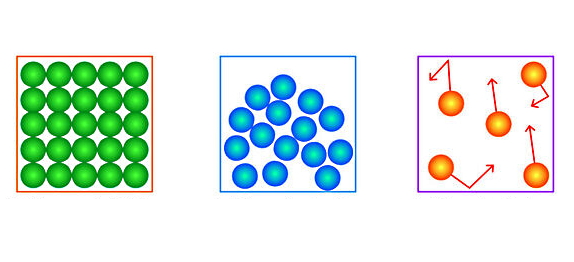
ذرات مایع در حالی که به سمت هم جذب میشوند، میتوانند آزادانه هم حرکت کنند. این مسئله باعث می شود مایعات تراکمناپذیر باشند، اما شکل ظرفی که در آن ریخته میشوند را به خود بگیرند. چگالی مایعات کمی از چگالی جامدات کمتر است (بهطور میانگین حدود ۱۰ درصد کمتر است).
با اینکه اندازه نیروهای بینمولکولی در مایعات آنقدر قوی نیست که مانند جامدات ساختار محکمی از ماده بسازد، اما تا حدی هست که باعث شود این حالت ماده دارای خاصیت چسبندگی و کشش سطحی باشد. چسبندگی همان مقاومت ماده در مقابل جاری شدن است. برخی مایعات راحتتر جاری میشوند، در حالی که بعضی دیگر به سختی جریان پیدا میکنند. برای مثال عنصر جیوه (Hg) فلز مایعی است که دارای چسبندگی و مقدار کشش سطحی بالایی است و به سختی جاری میشود.

همچنین آب بهعنوان مثال مهمی از حالت مایع یک ماده، دارای خصوصیات جالبتوجهی است. اگر آب منجمد شود، دچار انبساط خواهد شد و این یکی از خواص جالب آب بهعنوان یک مایع است که از تشکیل پیوند هیدروژنی بین مولکولهای آب نتیجه میشود.
ویژگیهای حالت گاز چیست؟
در این بخش به این مبحث خواهیم پرداخت که خصوصیات حالت ماده در ابتدای فرآیند چگالش چیست. برای شروع چگالش، ماده باید در حالت گاز باشد. ذرات یک گاز، انرژی جنبشی لازم برای غلبه بر نیروهای بینمولکولی ضعیف بین هم دیگر را دارند. پس این ذرات میتوانند بدون اینکه جذب هم شوند (برخلاف ذرات تشکیلدهنده مایعات)، در جهتهای تصادفی آزادانه و با سرعت بالایی حرکت کنند، طوری که با دیوارههای ظرفی که در آن قرار دارند نیز برخورد دارند.
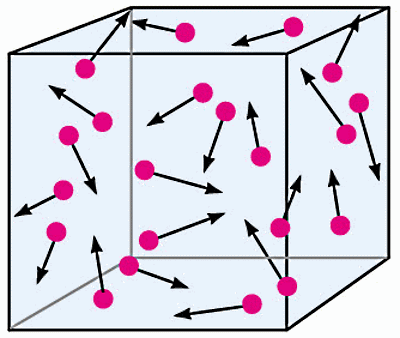
در نتیجه، گازها نه شکل تعریفشده و مشخصی دارند و نه حجم تعریفشده و مشخصی. گازها چگالی خیلی کم (تقریبا ۱۰۰۰ برابر کمتر از مایعات و جامدات) و تراکمپذیری بالایی دارند، میتوانند بهخوبی در محیط پراکنده شوند و به سطوحی که با آنها برخورد دارند، فشار وارد کنند. عناصر زیادی در دمای اتاق گازاند، مثل هیدروژن (H)، هلیوم (He) و فلوئور (F).
اگر در انتهای این بخش خواص جامدات، مایعات و گازها را مقایسه کنیم، متوجه خواهیم شد که مایعات از نظر ویژگیها و خواص، در جایی بین خصوصیات جامدات و گازها قرار میگیرند. به همین علت است که انتظار داریم زمانی که مادهای از حالت گاز به جامد تغییر حالت میدهد، ابتدا از حالت مایع عبور کند.
| گاز | مایع | جامد |
| حجم تعریفنشده | حجم تعریفشده | حجم تعریفشده |
| شکل تعریفنشده (شکل ظرف را دارد) | شکل تعریفنشده (شکل ظرف را دارد) | شکل تعریفشده |
| نیروی بینمولکولی ضعیف | نیروی بینمولکولی متوسط | نیروی بینمولکولی قوی |
| تراکمپذیر | تراکمناپذیر | تراکمناپذیر |
| چگالی پایین | چگالی متوسط | چگالی بالا |
| حرکت آزادانه ذرات
(بدون هیچ نیروی جاذبه نسبت به هم) |
حرکت آزادانه ذرات
(دارای نیروی جاذبه نسبت به هم) |
ذرات ثابت در جای خود
(حرکت نوسانی) |
| قابلیت جاری شدن دارد. | قابلیت جاری شدن دارد. | قابلیت جاری شدن ندارد. |
| استحکام ندارد. | استحکام متوسطی دارد. | استحکام بالایی دارد. |
همانطور که چند بار تکرار شد، در چگالش تبدیل گاز به مایع و سپس مایع به جامد اتفاق نمیافتد. اما برای مواد زیادی به جای تبدیل مستقیم گاز به جامد، ابتدا گاز به مایع و سپس مایع به جامد تبدیل میشود. در بخشهای بعد توضیح خواهیم داد که برای رخ دادن چگالش، دقیقا به چه شرایطی نیاز داریم.
انواع تغییر حالتهای ماده
پس از اینکه یاد گرفتیم حالتهای ماده در چگالش چیست، در این قسمت به انواع تغییر حالتهای ماده اشاره میکنیم تا درک بهتری از تفاوتها و شباهتهای چگالش با سایر تغییر حالتهای ماده بهدست آوریم. جدول زیر، بیان میکند که هر تغییر حالت برابر با تبدیل کدام حالت از ماده به دیگری است.
| به گاز | به مایع | به جامد | |
| تصعید | ذوب | – | از جامد |
| تبخیر | – | انجماد | از مایع |
| – | میعان | چگالش | از گاز |
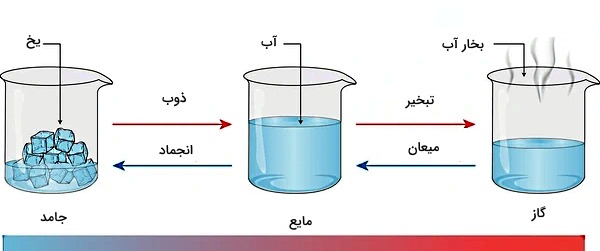
بنابراین شش تغییر حالت مختلف برای ماده داریم که عبارتاند از:
- ذوب: تغییر حالت ماده از جامد به مایع (آب شدن یخ در دمای اتاق)
- انجماد: تغییر حالت ماده از مایع به جامد (یخ زدن آب داخل فریزر)
- تبخیر: تغییر حالت ماده از مایع به گاز (جوشیدن آب روی حرارت)
- میعان: تغییر حالت ماده از گاز به مایع (تشکیل قطرات آب روی شیشه در حمام)
- تصعید: تغییر حالت مستقیم ماده از جامد به گاز (ناپدید شدن نفتالین در دمای اتاق)
- چگالش: تغییر حالت مستقیم ماده از گاز به جامد (تشکیل برفک در یخچال)
در ادامه این بخش، دو عامل ایجاد کننده تغییر حالت در ماده، یعنی دما و فشار را توضیح میدهیم.
اثر دما
یاد گرفتیم انواع تغییر حالتهای ماده از جمله چگالش چیست و مثالهایی برای هر کدام بیان کردیم. با دقت در مطالب گفته شده متوجه خواهیم شد که تغییرات دمایی علت اصلی عوض شدن حالت یک ماده است. برای نمونه، اگر یخ را از فریزر خارج کنیم، دمای آن را زیاد کردهایم. با افزایش دمای یخ، انرژی جنبشی مولکولهای ماده افزایش مییابد و در نتیجه ماده به نقطه ذوب خود میرسد. پس یخ با تبدیل شدن به آب، ذوب میشود. 
دقت کنید در طول این تغییر حالت، فقط دما زیاد شد و فشار ثابت مانده است. چنین فرآیندی را در ترمودینامیک، «فرآیند فشار ثابت یا همفشار» (Isobaric Process) مینامند. حالا اگر آب را حرارت دهیم، افزایش دما باعث تبخیر آب میشود و آن را به بخار تبدیل میکند. پس عامل اصلی دو تغییر حالت ذوب و تبخیر، افزایش دما است. اگر بخواهیم اثر دما را در تغییر حالتها با پارامتر مشخصی نشان دهیم، بهتر است از مفاهیمی مانند دمای ذوب و دمای جوش استفاده کنیم.
نقطه ذوب همان دمایی است که در آن ماده از جامد به مایع تبدیل میشود. یک ماده در فشارهای مختلف، دماهای ذوب مختلفی دارد. معمولا دمایی را که در آن ماده از حالت جامد به مایع در فشاری برابر با یک اتمسفر تغییر حالت میدهد، نقطه ذوب نرمال مینامند. به همین ترتیب، نقطه جوش ماده برابر است با دمایی که در آن حالت مایع ماده به گاز تبخیر میشود. هر عنصری در فشاری برابر با یک اتمسفر، دارای یک نقطه جوش نرمال است.
اما عکس این دو فرآیند، یعنی انجماد و میعان بر اثر کاهش دمای ماده اتفاق میافتند. برای مثال، بخار آب داخل فضای حمام دارای دمای بیشتری نسبت به سطح آینه حمام است. در نتیجه در اثر برخورد بخار آب با سطح آینه سردتر، طی فرآیند میعان، بخار آب به قطرات آب تبدیل میشود. یعنی با کاهش دمای بخار آب، آب تولید شده است. اگر این آب را داخل فریزر قرار داده و سردتر کنیم، یخ میزند (انجماد). پس انجماد و میعان در نتیجه کاهش دما ایجاد میشوند.

اثر فشار
در بخش قبل دیدیم اثر تغییرات دمایی روی چگالش چیست. بهجز دما فاکتور موثر دیگر روی تغییر حالت ماده، فشار است. اثر فشار برای تغییر حالتهای ذوب، انجماد، تبخیر و میعان قابل مقایسه با اثر دما نیست. ولی در مورد دو تغییر حالت جالب تصعید و چگالش تغییرات فشار نقش کلیدی دارد. در شکل زیر ظرفی را مشاهده میکنید که دارای یک پیستون در دهانه ورودی است. در سمت چپ تصویر، داخل ظرف از گاز پر شده است. اگر پیستون را به سمت پایین حرکت دهیم، گاز داخل ظرف متراکم میشود. در نتیجه، فشار وارد بر گاز را با این روش زیاد کردهایم.
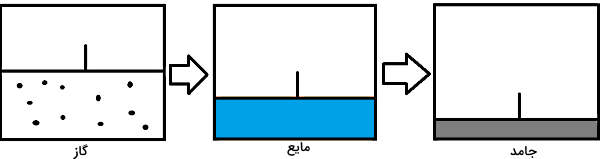
اگر گاز داخل ظرف طی این افزایش فشار به نقطه میعان خود برسد، شروع میکند به تبدیل شدن به مایع. با پایین بردن بیشتر پیستون داخل ظرف، فشار را بیشتر افزایش میدهیم. بنابراین مایع داخل ظرف به حالت جامد فریز خواهد شد. این شکل مثالی را نشان داد که در آن ماده با افزایش فشار و در یک دمای ثابت، ابتدا از حالت گاز به مایع و سپس از مایع به جامد تغییر حالت داد.
چنین فرآیندهای تغییر حالتی که در آنها فشار تغییر میکند، در حالی که دما ثابت است را «فرآیند دما ثابت یا همدما» (Isothermal Process) مینامند. در بخش بعد با توضیح نمودار فازی بهتر متوجه اثر دما و فشار روی تغییر حالت ماده خواهیم شد.
چگالش و نمودار فازی
در بخش گذشته آموختیم انواع تغییر حالتهای ماده از جمله چگالش چیست. همچنین گفتیم که علی رغم انتظارمان، در چگالش گاز مستقیما به جامد تبدیل میشود. این گفته به این معنا نیست که تبدیل گاز به مایع (میعان) و سپس مایع به جامد (انجماد) برای هیچ مادهای اتفاق نمیافتد. احتمال رخ دادن چنینی فرآیندهایی نسبت به چگالش حتی بیشتر هم هست. اما این روند، تعریف چگالش نیست. در چگالش، گاز مستقیما جامد میشود.
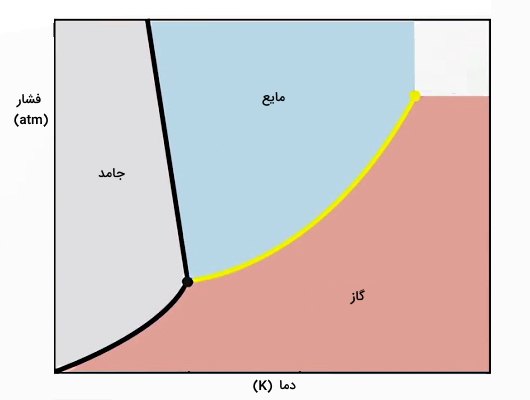
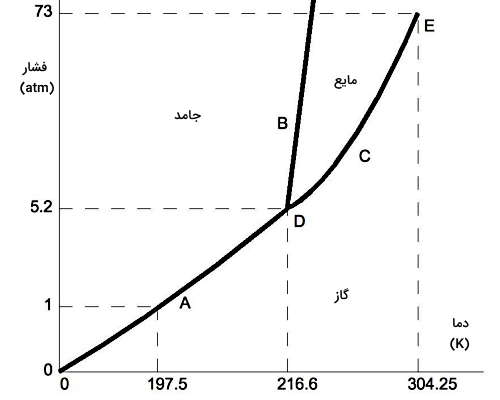
در این قسمت توضیح میدهیم در چه شرایطی میتوانیم بهجای دو فرآیند میعان و انجماد، چگالش داشته باشیم. برای این منظور، لازم است ابتدا با نمودار فازی و آثار دما و فشار روی تغییرات حالت ماده آشنا شویم. نمودار فازی نشاندهنده حالتهای فیزیکی مختلف ماده در فشار و دمای متفاوت است. در شکل بالا، یک نمودار فازی نوعی را مشاهده میکنید که مرزبندی سه حالت ماده در آن کاملا مشخص شده است.
معمولا در نمودار فازی، فشار در محور عمودی و دما در محور افقی قرار میگیرد. تغییر حالت ماده با خطوط یا منحنیهای مشخصی روی نمودار فازی نشان داده میشود. همچنین روی خطوط یا نقاط خاصی ممکن است دو یا سه حالت از ماده همزمان با هم وجود داشته باشند.
یک نمودار فازی دارای چند بخش مهم است که عبارتاند از:
- «نقطه سهگانه» (Triple Point): نقطهای از نمودار است که در آن هر سه حالت ماده یعنی جامد، مایع و گاز همزمان وجود دارند یا نقطهای که در آن هر سه حالت ماده در حالت تعادل هستند.
- «نقطه بحرانی» (Critical Point): نقطهای از نمودار است که در آن حالت ماده بین دو حالت گاز و مایع قرار دارد و قابلتشخیص نیست. به عبارت دیگر، در این نقطه فاز مایع و گاز ماده با هم یکی میشوند.
- منحنی ذوب یا Fusion یا انجماد (Freezing): منحنی روی نمودار فازی است که انتقال بین حالتهای مایع و جامد را نمایش میدهد.
- منحنی تبخیر یا میعان: منحنی روی نمودار فازی است که انتقال بین حالتهای مایع و گاز را نمایش میدهد.
- منحنی تصعید یا چگالش: منحنی روی نمودار فازی است که انتقال بین حالتهای گاز و جامد را نمایش میدهد.
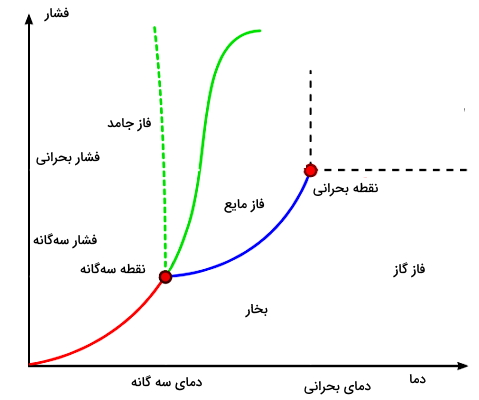
همانطور که گفتیم، در نمودار فازی معمولا فشار (برحسب اتمسفر) در مقابل دما (برحسب درجه سلسیوس یا کلوین) رسم میشود. در شکل بالا فشار و دمای متناظر با نقطه سهگانه برابر خواهند بود با فشار سهگانه (Ptp) و دمای سهگانه (Ttp). به همین صورت، فشار و دمای متناظر با نقطه بحرانی روی نمودار برابر هستند با فشار بحرانی (Pcr) و دمای بحرانی (Tcr).
در مورد نقطه بحرانی این نکته وجود دارد که در فشارهای بالاتر از فشار بحرانی، یک فاز یکی شده از مایع و گاز به نام شاره فوقبحرانی تشکیل میشود. تمام خطوط روی نمودار (خطوط سبز و آبی و قرمز) به این معنا هستند که روی این خطوط در شرایط دمایی و فشاری هستیم که در آن دو فاز مختلف میتوانند در حالت تعادل وجود داشته باشند.

همچنین این خطوط مرزهای تغییر فاز را معرفی میکنند. برای اینکه بهتر درک کنیم چطور ممکن است دو فاز همزمان وجود داشته باشد، یک ظرف یخ را در نظر بگیرد که در حال ذوب شدن است. داخل این ظرف هم یخ در حال ذوب (فاز جامد) و هم یخ ذوب شده (فاز مایع) وجود دارد.
خطوط تعادلی در نمودار فازی شکل بالا بهصورت زیر هستند:
- خط قرمز نشاندهنده نقاط تعادل ترمودینامیکی بین دو فاز گاز و جامد است (ناحیهای که در چگالش برای ما مهم است).
- خط سبز، دو فاز جامد و مایع را از هم جدا کرده است و نشاندهنده مرزی است که دو تغییر حالت ذوب و انجماد اتفاق میافتند.
- خط آبی فازهای مایع و گاز را به دو بخش مجزا تقسیمبندی کرده است و مرز تغییر حالتهای تبخیر و میعان را مشخص میکند.
بنابراین تمام نقاطی که روی خط قرمز قرار میگیرند، مقادیر مختلف دما و فشاری هستند که در آنها ماده همزمان هم در حالت جامد و هم در حالت گاز قرار دارد. اگر مقدار خیلی کمی این مقادیر فشار یا دما جابجا شوند، ماده دیگر در نقطه تعادلی نیست. بنابراین ماده یا گاز است یا جامد و خط قرمز نشاندهنده مرز تبدیل مستقیم ماده از جامد به گاز (تصعید) یا تبدیل مستقیم ماده از گاز به جامد (چگالش) است.
حالا با یاد گرفتن نمودار فازی و اطلاعاتی که به ما میدهد، بهتر متوجه خواهیم شد چگونه میتوانیم تشخیص بدهیم که آیا گاز موردنظر ما توانایی تبدیل مستقیم به جامد یا چگالش را دارد یا نه. از جمله اطلاعاتی که از نمودار فازی استخراج شده این است که اگر در امتداد یک خط دما ثابت حرکت کنیم، چگالی نسبی فازها بهدست میآید و با حرکت از سمت پایین به بالای نمودار، مقادیر چگالی نسبی زیاد میشوند. حرکت در راستای یک خط فشار ثابت نیز مقادیر انرژی نسبی فازها را میدهد، که با حرکت از سمت چپ نمودار به سمت راست آن، انرژیهای نسبی افزایش مییابند.
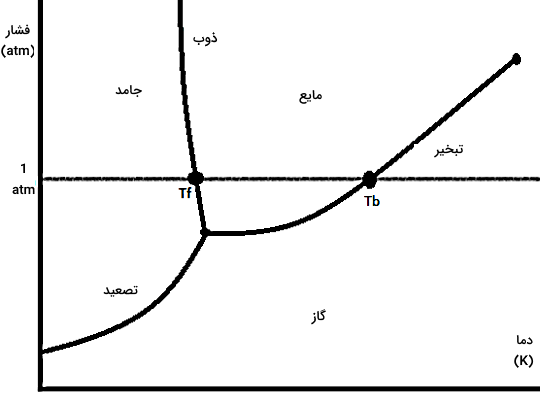
در نمودار فازی شکل بالا، خطوط تعادلی متناظر با سه تغییر حالت ذوب، تبخیر و تصعید نشان داده شده است. همچنین نقاط Tf برابر با نقطه ذوب و Tb معادل با نقطه جوش برای مقدار فشار ثابت یک اتمسفر مشخص شدهاند. همانطور که گفتیم در فشار یک اتمسفر، این دماها دمای نرمال نامیده میشوند. اگر دقت کنید، نمودار گوشه سمت چپ، جایی است که شرایط دمایی و فشار لازم برای رخ دادن تغییر حالت مستقیم جامد به گاز یا تصعید و فرآیند عکس آن یعنی چگالش را نشان میدهد.
طبق شکل بالا، برای بیشتر مواد، دما و فشار متناظر با نقطه سهگانه زیر مقادیر دما و فشار استاندارد است. همچنین مقادیر دما و فشار متناظر با نقطه بحرانی هم بالاتر از مقادیر دما و فشار استاندارد قرار میگیرد. این مسئله باعث میشود برای بیشتر مواد در فشار استاندارد، با افزایش دما ماده ابتدا از جامد به مایع (ذوب) و سپس از مایع به گاز (تبخیر) تبدیل شود.
همچنین اگر در دمای استاندارد بمانیم و فشار را زیاد کنیم، بیشتر مواد از گاز به مایع (میعان) و سپس از مایع به جامد (انجماد) تبدیل خواهند شد. به این علت است که برای بیشتر مواد، دو تغییر حالت ذوب و تبخیر بهجای تصعید و دو تغییر حالت میعان و انجماد بهجای چگالش رخ میدهند. در ادامه مطالب این بخش، بهتر متوجه میشویم چگالش چیست.
نمودار فازی دیاکسید کربن
در این قسمت برای اینکه ببینیم کاربرد نمودار فازی در تشخیص شرایط لازم برای تغییر حالت چگالش چیست، مثال نمودار فازی دیاکسید کربن را بیان میکنیم. ابتدا میخواهیم مشخص کنیم که دیاکسید کربن در دما و فشار استاندارد، یعنی در فشار ۱ atm و دمای ۲۵ C چه فازی دارد. اگر نقطه متناظر با این دما و فشار را در نمودار پیدا کنیم، میبینیم که این نقطه در قسمت صورتی نمودار، یعنی در فاز گاز قرار میگیرد. دقت کنید محور عمودی نمودار نشاندهنده مقادیر فشار برحسب اتمسفر است.
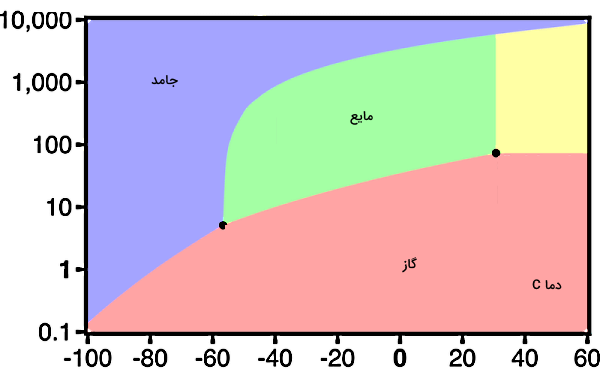
پس تا اینجا از نمودار فازی متوجه شدیم که دیاکسید کربن در دمای ۲۵ C و فشار ۱ atm در حالت گازی است. حالا اگر به نمودار بالا بیشتر دقت کنید، خواهید دید که برای دیاکسید کربن نقطه ذوب نرمال یا نقطه جوش نرمال وجود ندارد. یک بار دیگر تعریف نقطه ذوب نرمال را مرور میکنیم: دمایی که در آن ماده از حالت جامد به مایع در فشاری برابر با یک اتمسفر تغییر حالت میدهد.
طبق تعریف، نقاط نرمال نقاطی هستند که دو مشخصه تغییر حالت و فشار یک اتمسفر را همزمان داشته باشند. تغییر حالت ذوب در خط مرزی رنگ سبز و بنفش رخ میدهد که خیلی بالاتر از خط افقی معادل با فشار یک اتمسفر قرار دارد. در واقع چون نقطه سهگانه برای این ماده از فشار ۱ atm بالاتر قرار گرفته است، پس این ماده اگر بخواهد در فشار یک اتمسفر از حالت گازی به جامد تبدیل شود، نمیتواند ابتدا از گاز به مایع (میعان) و سپس از مایع به جامد (انجماد) تبدیل شود.
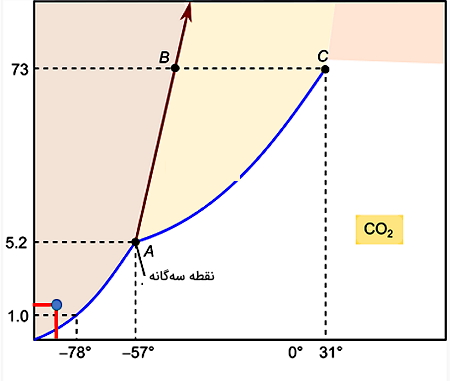
اما این امکان برای دیاکسید کربن گازی وجود دارد که در دمای منفی حدود ۷۸ C- و در فشار یک اتمسفر، مستقیما از گاز به جامد تبدیل شود. علت این امکانپذیری برای دیاکسید کربن این است که نقطه سهگانه این ماده از فشار استاندارد یک اتمسفر بالاتر است. همینجا میتوانیم نتیجهگیری کنیم موادی میتوانند در فشار استاندارد تغییر حالتهای مستقیم گاز به جامد و برعکس را تجربه کنند که دارای نقطه سهگانه بالاتر از فشار استاندارد باشند.
نمودار فازی آب
دیدیم که مفهوم نمودار فازی و اثر نقطه سهگانه در چگالش چیست. بهتر است در این بخش نمودار فازی آب را بهعنوان مادهای که روزمره از آن در حالتهای مختلفی استفاده میکنیم، دقیقتر بررسی کنیم. در نمودار فازی بیشتر مواد، خط مرزی فازهای مایع و جامد دارای شیب مثبت است. اما برای آب، خط مرزی فاز مایع و جامد در نمودار فازی شیب منفی دارد. در شکلهای زیر میتوانید نمودار فازی آب (H2O) و دی اکسید کربن (CO2) را از این نظر با هم مقایسه کنید.
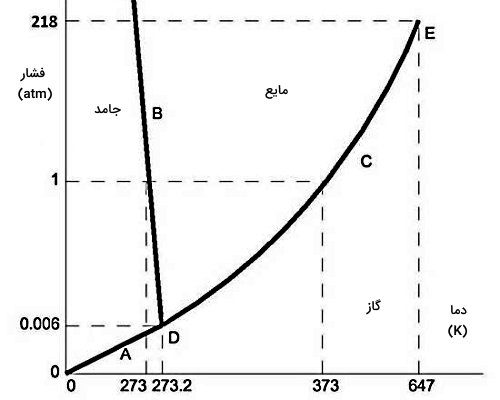
این استثنا برای آب نشان میدهد که فاز مایع آب از فاز جامد آن یعنی یخ، چگالتر است. علت این پدیده برای آب، به ساختار بلوری فاز جامد آب برمیگردد. در فاز جامد آب یا همان یخ، مولکولها در شبکهای بلورین کنار هم قرار میگیرند که میانگین فواصل بینمولکولی بیشتری نسبت به آب دارد. پس برای آب، حالت جامدی با چگالی کمتر نسبت به حالت مایع شکل میگیرد. همین استثنا باعث میشود که یخ را فقط با اعمال فشار و بدون گرم کردن هم بتوانیم ذوب کنیم.
ترمودینامیک تغییر فاز
تا اینجا آموختیم که طبق نمودار فازی چگالش چیست و در چه شرایطی ایجاد میشود. اگر بخواهیم در مورد تغییر فازهای مختلف ماده از جمله چگالش، اطلاعات کاملتری داشته باشیم، بهتر است با روابط ترمودینامیکی حاکم بر این فرآیندها نیز آشنا شویم. دو پارامتر مهم در تبدیل فازها، دما و فشار هستند. دما را با T نشان میدهیم که عموما در مسائل ترمودینامیکی برحسب کلوین (K) اندازهگیری میشود.
در ترمودینامیک، برای حالت گازی رابطه بین دما و فشار طبق معادلات زیر بیان میشود:
این رابطه برای یک گاز ایدهآل است و قانون گازهای ایدهآل درنظر گرفته میشود. در این رابطه فشار (P) برحسب پاسکال (Pa)، حجم (V) برحسب متر مکعب (m۳)، n یک عدد صحیح و بدون واحد و R یک عدد ثابت است به نام ثابت جهانی گازها. مقدار R برابر است با ۸٫۳۱۴ J/mol.K. قانون گازهای ایدهآل این فرض را در نظر میگیرد که هیچ نیروی بینمولکولی موثری روی ذارت تشکیلدهنده گاز تاثیری ندارد. البته میتوانیم با استفاده از معادله واندوالس که موضوع این مطلب نیست، آثار این نیروها را در محاسبات خود لحاظ کنیم.
مثالهایی از چگالش
در ادامه این مطلب، برای اینکه بهتر متوجه شویم چگالش چیست و چگونه در اطراف ما رخ میدهد، با بیان چند مثال به توضیح این نوع تغییر حالت ماده میپردازیم. همچنین در هر مثال علاوهبر چگالش، به چگونگی انجام فرآیند تصعید یعنی تغییر مستقیم جامد به گاز هم اشاره شده است.
یخزدگی گیاهان
یکی از مثالهای رایج و کمککننده برای اینکه بهتر درک کنیم چگالش چیست، فرآیندی است که در هوایی با دمای زیر نقطه انجماد آب (یعنی در دمای منفی) رخ میدهد. در چنین شرایطی هوا بدون اینکه اول به مایع یعنی آب تبدیل شود، مستقیما به یخ تبدیل میشود. این فرآیند همان «یخزدگی» (Frost) است که با الگوی بلورین روی سطح پنجره، سطح زمین یا روی برگهای گیاهان دیده میشود.

برای اینکه چگالش اتفاق بیفتد، لازم است انرژی گرمایی گاز یکه در اینجا همان هوای اطراف برگ گیاهان است، حذف شود. به عبارت دیگر، با حذف گرما یا سرد کردن گاز چگالش داریم. بنابراین برای اینکه برای مثال یخ زدگی روی برگ گیاهان را ببینیم، لازم است هوای اطراف برگها به میزان کافی گرما از دست داده باشد تا مستقیما به بلورهای جامد یخ تبدیل شود.
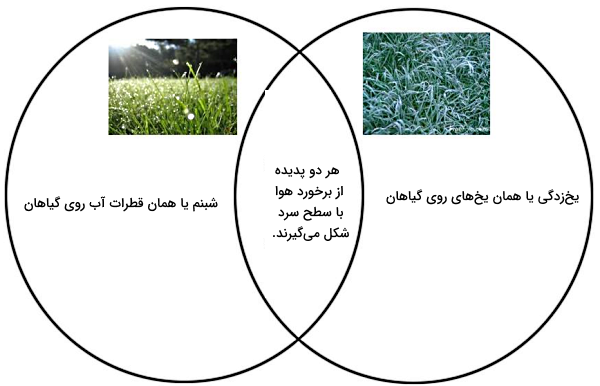
گاهی ممکن است دمای هوای اطراف برگ گیاهان زیر «نقطه شبنم» (Dew Point) باشد، اما راهی برای حذف گرمای نهان بخار آب وجود نداشته باشد و در نتیجه هوا نتواند خود به خود متراکم شود. در این شرایط اگر دمای هوا تا کمتر از نقطه انجماد آب کاهش پیدا کند، نقطه شبنم با «نقطه برفک» (Frost Point) برابر میشود. پس به جای قطرات آب یا شبنم، روی سطوح یخزدگی ایجاد خواهد شد.
اگر دقت کرده باشید، در تشکیل شبنم روی برگ گیاهان، اتفاقی که میافتد همان فرآیند تغییر حالت میعان است. این در حالی است که تشکیل برفک یا یخزدگی روی برگ گیاهان، همان فرآیند تغییر حالت چگالش و تبدیل مستقیم بخار آب به یک جامد است. بد نیست در ادامه این بخش، با مفهوم نقطه شبنم نیز بیشتر آشنا شویم و یاد بگیریم تاثیر آن در چگالش چیست.
نقطه شبنم چیست؟
در ادامه کسب اطلاعات بیشتر در مورد اینکه چگالش چیست، در این بخش مفهوم نقطه شبنم را توضیح میدهیم. هوا میتواند مولکولهای آب را در خود نگه دارد. به مقدار آبی که در هوا وجود دارد، «رطوبت هوا» (Air Humidity) گفته میشود. هر چه هوا گرمتر باشد، مولکولهای آب بیشتر یا رطوبت بیشتری در هوا وجود دارد. بنابراین در هوای سردتر، مولکولهای آب کمتر یا رطوبت کمتری وجود دارد.

دمای شبنم دمایی از هوا است که در آن مقدار رطوبت نسبی هوا به ۱۰۰ درصد میرسد و بخارآب شروع به تبدیل شدن به قطرات آب میکند. منظور از رطوبت ۱۰۰ درصد هوا این است که بیشترین مولکولهای آب ممکن در هوا قرار دارند و بیشتر از این، امکان وجود مولکول آب در هوا وجود ندارد. به عبارت دیگر، دمای شبنم همان دمای هوا است زمانی که هوا نیاز به سردتر شدن دارد تا به قطرات آب یا همان شبنم تبدیل شود.
در سمت چپ تصویر پایین، مولکولهای آب موجود در هوای گرم نشان داده شده است. اگر این هوای گرم به دمای شبنم برسد، با سردتر شدن آن تعدادی از این مولکولهای آب کنار هم قرار میگیرند و به قطرات آب یا شبنم تبدیل میشوند. به این ترتیب، تعداد مولکولهای آب یا رطوبت هوای سرد کاهش مییابد.

پس برای اینکه هوا با بخار آب اشباع شود، لازم است تا یک دمایی سرد شود. این دما همان نقطه شبنم است. اصولا نقطه شبنم به فشار و مقدار آب موجود در هوا یا رطوبت هوا بستگی دارد. هر چه رطوبت هوا بیشتر باشد، نقطه شبنم هوا نیز بیشتر است. بنابراین وقتی که هوا تا زیر نقطه شبنم سرد شود، ظرفیت رطوبتی هوا کاهش خواهد یافت و بخار آب موجود در هوا متراکم می شود تا به مایع (آب) تبدیل شود. این قطرات آب، شبنم نامیده میشوند.
به عبارت دیگر، اگر دمای هوا از نقطه شبنم کمتر شود، بخشی از آب موجود در هوا در واقع تقطیر میشود. چنانچه این پدیده در اثر تماس مستقیم هوا با یک سطح سردتر (مثل شیشه پنجرهها یا برگ گیاهان) اتفاق بیفتد، قطرات شبنم روی این سطح شکل میگیرند.
برفک یخچال یا فریزر
تا اینجا آموختیم که علت یخزدگی گیاهان طی فرآیند چگالش چیست. تشکیل برفک در یخچال یا فریزر نیز بر همین اساس است. معمولا در شرایطی که فریزر یا یخچال در محیط مرطوب نگه داشته شوند (مثلا نگهداری فریزر داخل پارکینگ در تابستان)، این پدیده بیشتر مشاهده میشود.

داخل فریزر، با اینکه قطعات یخ منجمد هستند، اما بهآهستگی طی تصعید به بخار تبدیل میشوند. این بخار تولید شده در برخورد با سطوح سرد و بهخصوص در برخورد با المنتهای سرد فریزر، بهصورت حالت جامد رسوب میکند که برفک نامیده میشود. همین مسئله موجب میشود فریزر به «یخزدایی» (Defrost) نیاز پیدا کند. بنابراین اگر داخل فریزر یخ قرار نداشته باشد، نیاز به یخزدایی از فریزر کمتر است. همچنین با کاهش دمای فریزر هم اغلب میتوان از نیاز به یخزدایی پیشگیری کرد.
تشکیل دوده
مثال مرسوم دیگر برای اینکه بهتر متوجه شویم چگالش چیست، تشکیل «دوده» (Soot) روی دیواره دودکشها است. دوده مخلوطی از چند ماده آلی مثل کربن است که بر اثر سوختن ناقص هیدروکربنهای سنگین ایجاد میشود. منظور از سوختن ناقص فرآیندی است که در آن اکسیژن کافی برای سوختن مواد فراهم نیست.

مولکولهای جامد دوده مستقیما از گازهای داغ آتش ناشی از فرآیند سوختن ناقص، تولید میشوند، به این صورت که زمانی که این گازهای داغ با سطوح خنکتر دودکش تماس پیدا میکنند، سرد میشوند و مستقیما به مولکولهای جامد دوده تبدیل میشوند. از این فرآیند طبیعی ایده گرفته شده است و در صنعت بهعنوان تکنیک «لایه نشانی یا رسوب بخار شیمیایی احتراق» (Combustion Chemical Vapor Deposition | CCVD) کاربرد دارد. در بخش کاربرد چگالش در صنعت، راجعبه این مبحث بیشتر توضیح خواهیم داد.
تشکیل یخ خشک از دیاکسیدکربن
تا اینجا با بیان سه مثال، بهتر متوجه شدیم که چگالش چیست. در این قسمت بهعنوان آخرین مثال، به چگالش دیاکسید کربن گازی به «یخ خشک» (Dry Ice) اشاره میکنیم. یخ خشک همان دیاکسید کربن جامد است. اگر به بخش نمودار فازی دیاکسید کربن مراجعه کنید، در آنجا توضیح دادیم که چگونه به علت بالاتر بودن فشار نقطه سهگانه در این ماده، این تغییر حالت برای یخ خشک رخ میدهد.

یخ خشک در دمای -۷۸٫۵ C یا -۱۰۹ F به گاز دیاکسید کربن تصعید میشود. در واقع، علت نامگذاری دیاکسید کربن جامد به یخ خشک این است که این ماده بدون عبور از فاز مایع، مستقیما از جامد به گاز تبدیل میشود. البته مطالبی که گفتیم به این معنا نیست که دیاکسید کربن هرگز در حالت مایع وجود ندارد، بلکه این ماده در فشارهای خیلی بالا میتواند به حالت مایع تبدیل شود. از یخ خشک برای نگهداری نمونههای پزشکی استفاده میشود.
کاربردهای چگالش در صنعت
با توجه به مثال تشکیل دوده، میتوانیم تاحدی حدس بزنیم که کاربردهای صنعتی تغییر حالت چگالش چیست. اگر با «فرآیندهای لایهنشانی» (Coating Process) آشنایی داشته باشید، یکی از تکنیکهایی که برای پوششدهی یا لایهنشانی سطوح بکار میرود «رسوب تبخیری» (Evaporative Deposition) یا «تبخیر حرارتی» (Thermal Evaporation) در خلاء است.
در این روش یک ماده جامد در یک محفظه با فشار پایین حرارت داده میشود تا به حالت گازی تبدیل شود. مولکولهای گاز تولید شده پس از عبور از فضای محفظه، روی سطح موردنظر یا سطح هدف به حالت جامد رسوب میکنند. چنین رسوبی یک «لایه نازک» (Thin Film) و یکنواخت را روی سطح هدف موردنظر ایجاد میکند.
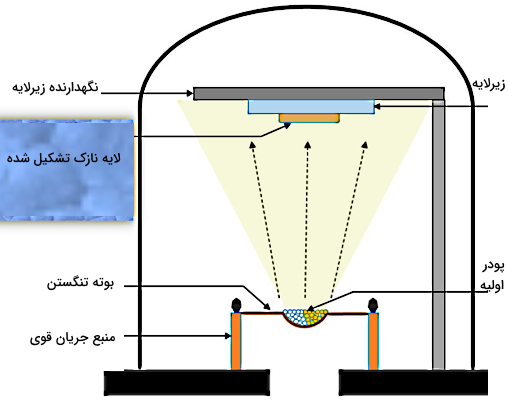
شکل بالا محفظه داخل یک دستگاه تبخیر حرارتی در خلاء را نشان میدهد. پودر اولیه در داخل بوتهای از جنس تنگستن قرار میگیرد. پس از اینکه طی حرارتدهی و در خلاء مورد نیاز پودر به بخار تبدیل شد، بخار حاصل با برخورد به سطح بالای محفظه با نام زیرلایه، روی این سطح لایه جامد نازکی تشکیل میدهد.

بنابراین در این روش، گاز بدون عبور از حالت مایع مستقیما به رسوب جامد تبدیل شد و یک لایه جامد نازک و یکنواخت روی سطح ایجاد کرده است. تشکیل لایهای با ضخامت ناچیز (طوری که به آن بتوانیم لایه نازک بگوییم)، به همراه این نکته که لایه تولید شده در نقاط مختلف خود یکنواخت باشد، از اهمیت زیادی برای کاربرد در صنعت برخوردار است. پس آموختیم که کاربرد صنعتی چگالش چیست.
گرمادهی چگالش
در این بخش میخواهیم بررسی کنیم وضعیت گرما در چگالش چیست، یعنی در چگالش گرما دریافت میشود یا گرما آزاد میشود. تغییر حالت چگالش همراه با رهاسازی گرما است. در نتیجه چگالش یک فرآیند «گرماده» (Exothermic) محسوب میشود. ابتدا باید ببینیم تعریف دو فرآیند گرماده و گرماگیر چیست.
در فرآیند یا واکنش گرماده انرژی حاصل از انجام فرآیند به محیط اطراف منتقل میشود. در نتیجه دمای محیط بالا میرود. از طرفی در یک فرآیند گرماگیر، فرآیند زمانی انجام میشود که گرما از محیط اطراف جذب شود. پس از رخ دادن یک فرآیند گرماگیر، دمای محیط کم میشود. شکل زیر نمودار تغییرات انرژی را برای یک واکنش گرماگیر و گرماده نشان میدهد که در هر دو نمودار، دو واکنشدهنده A و B به محصول C تبدیل میشوند.
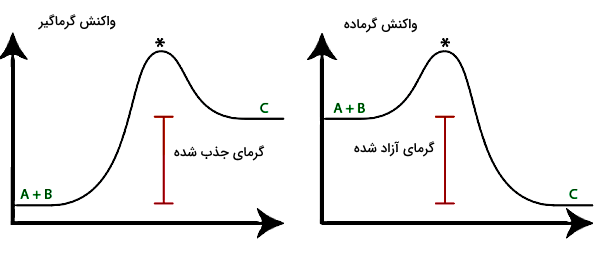
همانطور که در شکل مشخص است، در واکنش گرماگیر همزمان با ترکیب A و B از محیط اطراف انرژی گرمایی جذب میشود. بنابراین محصول C دارای سطح انرژی بالاتری نسبت به دو ماده اولیه است. اما در واکنش گرماده، همزمان با انجام واکنش و تولید C، گرما آزاد میشود. بنابراین سطح انرژی محصول C نسبت به دو واکنشدهنده A و B کاهش پیدا کرده است. بهطور مشابه میتوانیم بگوییم با تبدیل گاز به جامد در چگالش، دمای محیط زیاد میشود، در حالی که دمای جامد تولید شده نسبت به دمای گاز اولیه کمتر است.
تکمیل یادگیری چگالش با فرادرس
در این مطلب سعی کردیم شما را با این مفهوم که چگالش چیست و چگونه ایجاد میشود، آشنا کنیم. اگر در مقاطع دانشگاهی مشغول به تحصیل هستید و به دنبال این هستید که به مطالب پیشرفتهتری در مورد انواع تغییر حالتهای ماده بهخصوص فرآیند چگالش و کاربردهای آن دسترسی داشته باشید، مشاهده فیلمهای آموزشی زیر از مجموعه فرادرس را به شما پیشنهاد میکنیم:
- فیلم آموزش شیمی عمومی فرادرس
- فیلم آموزش شیمی عمومی ۱ و ۲ مرور و حل مساله فرادرس
- فیلم آموزش رایگان آشنایی با انواع تغییرات فیزیکی فرادرس
- فیلم آموزش جداسازی اجزای مخلوط ها در شناسایی ترکیبات آلی فرادرس
- فیلم آموزش شناسایی ترکیبات آلی فرادرس
- فیلم آموزش اصول استخراج فلزات (پیرومتالورژی) فرادرس
آزمون چگالش
در انتهای این مطلب از مجله فرادرس و پس از اینکه یاد گرفتید چگالش چیست و چگونه ایجاد میشود، میتوانید برای سنجش دانش خود در مورد این مبحث، به سوالات آزمون زیر پاسخ دهید. پس از پاسخدهی با کلیک روی بخش «دریافت نتیجه آزمون» میتوانید نمره نهایی خود را مشاهده کنید.
کدام گزینه عامل تغییر حالت ماده است؟
گزینه دوم و سوم صحیح است.
گزینه آخر درست است. همانطور که گفتیم طبق نمودار فازی، این دما و فشار ماده است که تعیین میکند آیا امکان تغییر حالت ماده وجود دارد یا نه.
تشکیل شبنم روی گیاهان در اثر تغییر حالت … است، در حالی که یخزدگی روی گیاهان در اثر تغییر حالت … رخ میدهد.
گزینه سوم درست است. تبرید و شبنم جز تغییر حالتها محسوب نمیشوند. شبنم روی گیاهان همان قطرات مایع آب هستند که از سرد شدن هوا ایجاد میشوند. پس تغییر حالت گاز به مایع یا میعان داریم. در یخزدگی گیاهان، هوای اطراف گیاه مستقیما به یخ تبدیل میشود. پس چگالش داریم.
کدام گزینه در مورد چگالش درست است؟
چگالش نوعی تغییر شیمیایی گرماده است.
چگالش نوعی تغییر شیمیایی گرماگیر است.
چگالش نوعی تغییر فیزیکی گرماده است.
چگالش نوعی تغییر فیزیکی گرماگیر است.
گزینه سوم درست است. در بخشهای آخر مطلب گفتیم که تمام تغییر حالتهای ماده از جمله چگالش تغییر فیزیکی محسوب میشوند. همچنین چگالش فرآیندی است که در آن گرما به محیط داده میشود.
در چگالش با … دما مستقیما … به … تبدیل میشود.
کاهش – گاز – جامد
کاهش – جامد – گاز
افزایش – گاز – جامد
افزایش – جامد – گاز
گزینه اول صحیح است. در چگالش گرما به محیط داده میشود. بنابراین چگالش یک فرآیند گرماده است که با سرد کردن گاز و تبدیل مستقیم آن به جامد اتفاق میافتد.
کدام گزینه در مورد تشکیل برفک در فریزر صحیح است؟
یخ داخل فریزر طی تصعید به بخار تبدیل میشود و این بخار در برخورد با المنتهای سرد فریزر، بهصورت جامد رسوب میکند.
یخ داخل فریزر طی تصعید به بخار تبدیل میشود و این بخار در برخورد با المنتهای سرد فریزر، به مایع تبدیل میشود.
یخ داخل فریزر طی انجماد به بخار تبدیل میشود و این بخار در برخورد با المنتهای سرد فریزر، بهصورت جامد رسوب میکند.
یخ داخل فریزر طی تبرید به بخار تبدیل میشود و این بخار در برخورد با المنتهای سرد فریزر، بهصورت جامد رسوب میکند.
گزینه اول درست است. همانطور که در بخش تشکیل برفک در فریزر گفتیم، ابتدا یخهای داخل فریزر تصعید میشوند. از تصعید این یخها، بخار تولید شده در برخورد با سطوح سرد از جمله المنتها مستقیما به یخ تبدیل میشود.
کدام گزینه چگالش محسوب نمیشود؟
تشکیل شبنم روی برگ گیاهان
تشکیل برفک در یخچال
یخزدگی برگ گیاهان
گزینه دوم درست است. در واقع تشکیل شبنم بهنوعی فرآیند تغییر حالت میعان است نه چگالش.
علت اینکه در هوای سرد رطوبت هوا کمتر است، چیست؟
در هوای سرد تعداد مولکولهای آب بیشتری در هوا وجود دارد.
جمع شدن مولکولهای آب در کنار هم و تشکیل قطرات آب یا شبنم روی سطح، باعث میشود تعداد مولکولهای آب موجود در هوای سرد کم شود.
تشکیل شبنم باعث میشود تعداد مولکولهای آب بیشتری در هوای سرد داشته باشیم.
گزینه دوم درست است. با سرد شدن هوای گرمی که به نقطه شبنم رسیده است، برخی مولکولهای آب در کنار هم قرار میگیرند و با تشکیل شبنم روی سطح سردی مثل سطح برگ گیاهان، از تعداد مولکولهای آب در هوا کاسته میشود. در نتیجه رطوبت هوای سرد کم میشود.
در نمودار فازی دیاکسید کربن، نقطه سهگانه از فشار نرمال … است. در نتیجه برای این ماده تغییر حالت … یا … بهجای تغییر حالتهای … و … یا … و … داریم.
بالاتر – تصعید – چگالش – میعان- انجماد – ذوب – تبخیر
بالاتر – چگالش – تصعید – میعان – انجماد – ذوب – تبخیر
پایینتر – تصعید – چگالش – میعان- انجماد – ذوب – تبخیر
پایینتر – چگالش – تصعید – میعان – انجماد – ذوب – تبخیر
گزینه دوم درست است. در نمودار فازی CO2 محل قرارگیری نقطه سهگانه از فشار یک اتمسفر یا فشار نرمال بالاتر است. پس گزینه سوم و چهارم در این مرحله رد شدند.
این مسئله باعث میشود برای دیاکسید کربن گازی بهجای تغییر حالتهای میعان و انجماد، چگالش داشته باشیم. همچنین برای دیاکسید کربن جامد بهجای تغییر حالتهای ذوب و تبخیر، تغییر مستقیم جامد به گاز یا تصعید را داریم.
در نمودار فازی نقطهای که در آن هر سه حالت یا فاز ماده در تعادل ترمودینامیکی هستند، چه نام دارد؟
نقطه ذوب نرمال
نقطه جوش نرمال
گزینه آخر صحیح است. در نمودار فازی نقطه سهگانه همان نقطهای است که هر سه حالت ماده در آن در تعادل ترمودینامیکی هستند.
در تغییر حالت چگالش با … دما، انرژی جنبشی مولکولهای ماده … میشود و در نتیجه … شدن ذرات، ماده به .. تبدیل میشود.
کاهش – کم – نزدیکتر – مایع
افزایش – زیاد – دورتر – گاز
کاهش – کم – نزدیکتر – جامد
افزایش – زیاد – دورتر – مایع
گزینه سوم درست است. در چگالش تغییر حالت مستقیم ماده از گاز به جامد را داریم. پس گزینههایی که فاز مایع و گاز دارند، حذف میشوند.
چگالش با کاهش دما اتفاق میافتد، طوری که با کاهش دما انرژی جنبشی ذرات تشکیلدهنده گاز کم میشود. در نتیجه ذرات به هم نزدیکتر میشوند و با شکلگیری نیروهای بینمولکولی قوی، یک جامد را شکل میدهند.
تغییر فیزیکی چگالش
اگر با انواع تغییرات فیزیکی و شیمیایی آشنا باشید، در این بخش میخواهیم ببینیم از این نظر چگالش چیست و در کدام گروه قرار میگیرد. مهمترین خصوصیت یک تغییر فیزیکی این است که در این نوع تغییر ماده جدیدی تولید نمیشود، برخلاف یک تغییر شیمیایی که در آن محصول جدیدی حاصل میشود. برای مثال، اگر فرآیند زنگ زدن آهن را در نظر بگیرید، از ترکیب اکسیژن و آهن در حضور رطوبت یا آب، ماده جدیدی به نام زنگ آهن تولید میشود. پس این فرآیند، یک تغییر شیمیایی است.

منظور از ایجاد ماده جدید این است که ماده محصول دارای فرمول شیمیایی متفاوتی باشد.در رابطه بالا مشخص است که از ترکیب سه ماده مختلف یک ماده جدید ساخته شده است که دارای خواص متفاوتی است. اما برای مثال در چگالش CO2، فرمول شیمیایی دیاکسید کربن تغییر نمیکند. بر این اساس تمام تغییر حالتهای ماده شامل ذوب، انجماد، تبخیر، میعان، تصعید و چگالش همگی جز تغییرات فیزیکی هستند.
در فرآیندهایی که برای چگالش مثال زدیم، برای مثال تبدیل دیاکسید کربن گازی به یخ خشک یا تشکیل برفک یخچال، ماده جدیدی ساخته نمیشود، فقط حالت ماده عوض شده است. دیاکسید کربن از گاز به جامد و آب، از فاز بخار به فاز جامد یعنی یخ تبدیل شده است. بنابراین هر نوع چگالشی یک تغییر فیزیکی محسوب میشود.
source
