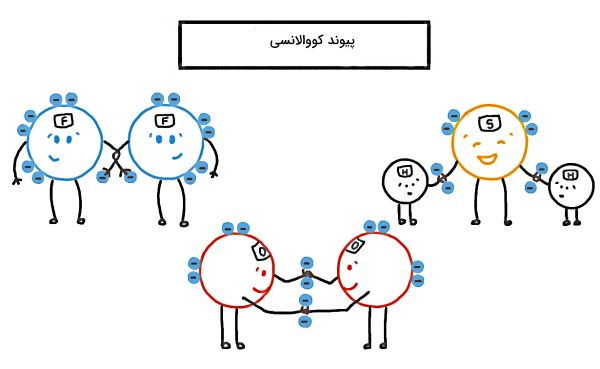
هر عاملی که باعث نگه داشتن اتمها، یونها و مولکولها در کنار هم برای تشکیل ساختاری از ماده میشود، «پیوند شیمیایی» (Chemical Bond) نام دارد و انواع پیوندهای شیمیایی عبارتاند از پیوند کووالانسی، پیوند یونی، پیوند فلزی، هیدروژنی، «نیروی پراکندگی لاندن» (London Dispersion Force) و برهمکنش دوقطبی – دوقطبی.

در مطالب قبلی گفتیم که تمام مواد از اتمها و مولکولها ساخته میشوند. اما برای تشکیل یک ماده فقط حضور اتم یا مولکول کافی نیست، بلکه لازم است این اتمها توسط یک نیروی جاذبه در کنار هم نگه داشته شوند تا مولکولها شکل بگیرند و از کنار هم قرار گرفتن مولکولها نیز، ساختارهای مختلفی مثل بلورها، فلزات یا هر شکل دیگری از ماده تشکیل شود. در این مطلب از مجله فرادرس ابتدا انواع پیوندهای شیمیایی را بر اساس «درونمولکولی» (Intramolecular) یا «بینمولکولی» (Intermolecular) بودن پیوند معرفی میکنیم. سپس با نحوه تشکیل هر پیوند، خصوصیات و تاثیری که روی شکلگیری خواص مختلف در مواد دارد، آشنا خواهیم شد.
انواع پیوندهای شیمیایی
پیوند شیمیایی نیروی جاذبه بین اتمها، یونها یا مولکولها است تا ساختار بزرگتری از ماده ساخته شود. انواع پیوندهای شیمیایی شامل موارد زیر هستند:
- پیوند کووالانسی
- پیوند یونی
- پیوند فلزی
- پیوند هیدروژنی
- نیروی پراکندگی لاندن
- برهمکنش دوقطبی – دوقطبی
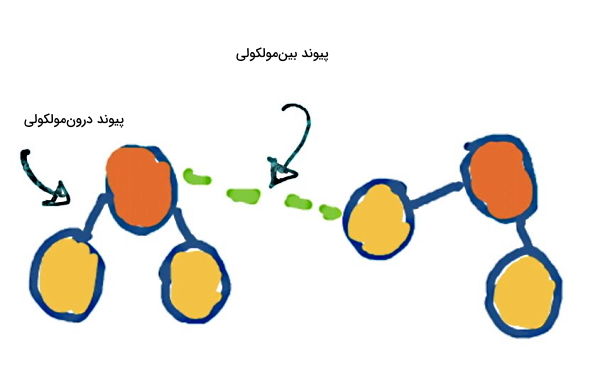
اگر پیوند شیمیایی بین اتمهای یک مولکول یا اتمهای یک عنصر برقرار شود، پیوند شیمیایی درونمولکولی، پیوند قوی یا اولیه نامیده میشود. مولفه اساسی در تشکیل این نوع پیوندها الکترون است که یا از اتمی به اتم دیگر منتقل میشود (پیوند یونی) و یا بین هسته دو اتم به اشتراک گذاشته میشود (پیوند کووالانسی). انواع پیوندهای شیمیایی درون مولکولی شامل پیوند کووالانسی، یونی و فلزی است.
نوع دیگری از پیوندهای شیمیایی پیوندهایی هستند که بین مولکولهای یک ماده شکل میگیرند و پیوند بینمولکولی، پیوند ضعیف یا ثانویه نام دارند. همانطور که از نامگذاری این دو گروه مشخص است، پیوندهای بین مولکولی نسبت به پیوندهای درونمولکولی ضعیفتر هستند. انواع پیوندهای شیمیایی بینمولکولی شامل پیوند هیدروژنی، نیروی پراکندگی لاندن و برهمکنش دوقطبی-دوقطبی است.
در جدول پایین تقسیمبندی کلی انواع پیوندهای شیمیایی نشان داده شده است. برای شناسایی بهتر ویژگیهای انواع پیوندهای شیمیایی از مفاهیم و نظریات مختلفی استفاده شده است که شامل نظریه کوانتومی، هیبریداسیون اوربیتالها، الکتروستاتیک، ترکیب خطی اوربیتالهای اتمی، نظریه اوربیتال مولکولی و ساختار رزونانسی است. بنابراین داشتن اطلاعات کلی در مورد هر کدام از این مباحث، به درک بهتر انواع پیوندهای شیمیایی کمک خواهد کرد.
| انواع پیوندهای شیمیایی | |||||
| پیوندهای درونمولکولی | پیوندهای بینمولکولی | ||||
| پیوند کووالانسی | پیوند یونی | پیوند فلزی | پیوند هیدروژنی | نیروی پراکندگی لاندن | برهمکنش دوقطبی – دوقطبی |
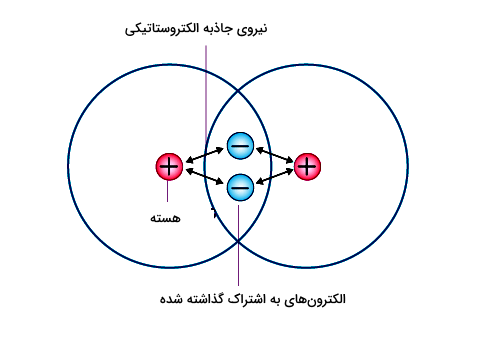
برای مثال اگر بخواهیم ببینیم اثر الکتروستاتیک در درک پیوندهای شیمیایی به چه صورت است، طبق قانون کولن میدانیم که بارهای الکتریکی ناهمنام یکدیگر را جذب میکنند. از آنجا که هسته اتم از پروتونهایی با بار مثبت و نوترونهایی بدون بار یا خنثی تشکیل شده است، بنابراین بار هسته مثبت است. پس در داخل اتم، الکترونهای دارای بار منفی که در اطراف هسته قرار دارند، جذب هسته دارای بار مثبت میشوند. به این ترتیب، اگر الکترونی بین دو هسته به اشتراک گذاشته شود، توسط هر دو هسته جذب خواهد شد.
در بخشهای بعدی هر کدام از انواع پیوندهای شیمیایی را با جزئیات کامل توضیح میدهیم. دقت کنید در کلیه شکلهای این مطلب، اغلب از نمایش الکترونهای داخلی اتمها صرفنظر شده است و فقط «الکترونهای ظرفیت» (Valence Electrons) هر اتم در شکلها نشان داده شده است. در مبحث پیوندهای شیمیایی، این الکترونهای ظرفیت هستند که در تشکیل پیوند سهم دارند و با الکترونهای داخلیتر اتم کاری نداریم. به همین دلیل بهتر است ابتدا با مفهوم الکترونهای ظرفیت بیشتر آشنا شویم.
الکترون ظرفیت چیست؟
گفتیم انواع پیوندهای شیمیایی همان نیروی جاذبه بین اتمها در یک ساختار هستند. این جاذبه یا پیوند، در نتیجه رفتار متفاوت بیرونیترین الکترونهای درون هر اتم یا همان الکترونهای ظرفیت ایجاد میشود. بنابراین برای اتمها در موقعیتهای مختلف، انواع پیوندهای شیمیایی مختلفی ممکن است داشته باشیم.
الکترونهای ظرفیت همان الکترونهایی از اتم هستند که در خارجیترین یا بیرونیترین لایه از ابر الکترونی دور هسته اتم قرار دارند. پس این الکترونها نیروی جاذبه کمتری از سمت هسته دریافت میکنند و جدا شدن آنها از اتم آسانتر است. بنابراین این الکترونهای ظرفیت اتم هستند که در پیوندهای شیمیایی شرکت دارند. برای بررسی تعداد الکترونهای ظرفیت اتمهای مختلف، میتوانید به جدول تناوبی عناصر مراجعه کنید.
در جدول بالا تعداد الکترونهای ظرفیت چند اتم آورده شده است. مفهوم مهم دیگر برای تشخیص بهتر الکترونهای ظرفیت و نحوه تشکیل پیوندهای مختلف، «آرایش الکترونی» (Electron Configuration) است که در بخش بعدی به این مبحث میپردازیم.
آرایش الکترونی چیست؟
برای شناخت انواع پیوندهای شیمیایی، بهتر است ابتدا به آرایش الکترونی برخی اتمهای مهم کاملا مسلط باشیم. آرایش الکترونی به نحوه قرار گرفتن الکترونها درون اوربیتالهای یک اتم یا مولکول گفته میشود. پیش از اینکه به ادامه مطلب بپردازیم، چنانچه تمایل داشته باشید در مورد چگونگی سوالات امتحانی مبحث توزیع الکترونها در اتم اطلاعات بیشتری کسب کنید، میتوانید فیلم آموزشی شیمی دهم حل سوالات تشریحی امتحانات نهایی فرادرس را که لینک آن در ادامه قرار داده شده است، مشاهده کنید.
نمایش آرایش الکترونی به این صورت است که تعداد الکترونهای هر کدام از اوربیتالهای s و p بهصورت یک بالانویس قرار داده میشود. برای نمونه آرایش الکترونی یک اتم اکسیژن تنها (اتمی که پیوند ندارد) با عدد اتمی ۸، به شکل زیر نمایش داده میشود:
نمایش بالا به این معنا است که در اتم اکسیژن اوربیتالهای 1s و 2s توسط دو الکترون و اوربیتال 2p توسط چهار الکترون پر شده است. بیرونیترین لایه اکسیژن (شامل اوربیتالهای 2s و 2p یا n=2) دارای چهار الکترون است. پس ظرفیت اکسیژن برابر است با ۴.
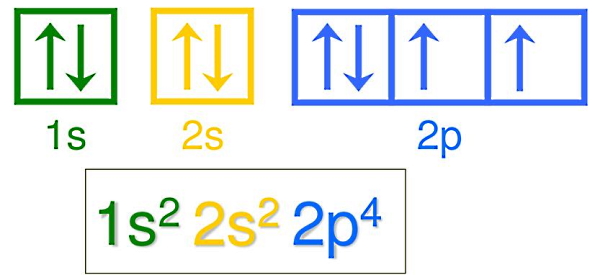
همچنین آرایش الکترونی بالا نشان میدهد که اتم اکسیژن برای پایداری بیشتر به دنبال تشکیل پیوند با اتمهایی است که بتوانند ظرفیت آن را کامل کنند. چون اوربیتال p حداکثر ۶ الکترون را در خود جای میدهد، پس اکسیژن برای پایداری بیشتر به ۲ الکترون نیاز خواهد داشت تا دو الکترون جفتنشده آن جفت شوند.
چرا پیوندهای شیمیایی تشکیل میشوند؟
در بخش قبل دیدیم که اتمهای مختلف در بیرونیترین لایه خود معمولا دارای الکترونهای جفتنشده هستند یا اوربیتالهای خالی دارند. به عبارتی اکثر اتمها در حالت عادی ناپایداراند. در جدول تناوبی عناصر، گروه خاصی به نام «گازهای نجیب» (Noble Gases) تنها عناصر پایدار در طبیعت را نشان میدهند که آرایش الکترونی کامل دارند و با اتم های دیگر پیوندی ندارند. بهجز گازهای نجیب، بقیه اتمها تمایل به تشکیل پیوند دارند تا با دریافت الکترون به پایداری بیشتر برسند.
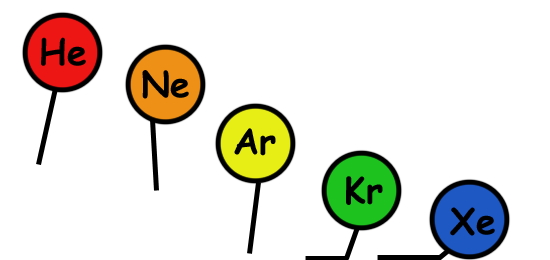
در شکل زیر آرایش الکترونی اتم فلوئور (F) با عدد اتمی ۹ را مشاهده میکنید که یکی از سه اوربیتال p برای این اتم، فقط یک الکترون دارد. مابقی اوربیتالهای اتم فلوئور کامل پر هستند و به حداکثر ظرفیت خود یعنی ۲ رسیدهاند. بنابراین اتم فلوئور با ظرفیت ۷، دارای یک الکترون جفتنشده در بیرونیترین لایه خود یعنی n=2 است و با پر کردن آن از طریق تشکیل پیوند با سایر اتمها به پایداری خواهد رسید.
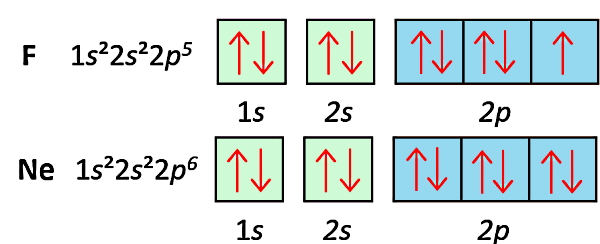
حالا اتم فلوئور را با اتم نئون (Ne) با عدد اتمی ۱۰ مقایسه کنید. نئون بهعنوان یک گاز نجیب، دارای آرایش الکترونی کامل است، به این معنا که تمام اوربیتالهای آن کامل پر شدهاند و جای خالی برای دریافت الکترون ندارد. پس نئون بهعنوان یک گاز نجیب تمایلی برای تشکیل پیوند شیمیایی ندارد و یک عنصر پایدار در طبیعت محسوب میشود.
یادگیری انواع پیوندهای شیمیایی با فرادرس
در بخش گذشته به انواع پیوندهای شیمیایی اشاره کردیم و مفاهیم مقدماتی موردنیاز برای درک انواع پیوندها را یاد گرفتیم. پیش از اینکه هر پیوند را جداگانه توضیح دهیم، اگر دانشآموز مقطع متوسطه هستید و تمایل دارید به مباحث مرتبط در کتابهای درسی کاملا مسلط شوید، مشاهده فیلمهای آموزشی زیر از فرادرس را به شما پیشنهاد میکنیم:
- فیلم آموزش علوم تجربی نهم شیمی فرادرس
- فیلم آموزش شیمی دهم فرادرس
- فیلم آموزش شیمی دهم حل سوالات امتحانات نهایی فرادرس
- فیلم آموزش شیمی دوازدهم فرادرس
- فیلم آموزش شیمی دبیرستان نکته و حل تست کنکور فرادرس
پیوند کووالانسی
برای اینکه با انواع پیوندهای شیمیایی بهتر آشنا شویم، لازم است بدانیم هر کدام از این پیوندها چگونه تشکیل میشوند و چه خصوصیاتی دارند. در این بخش فقط نحوه تشکیل پیوند کووالانسی را توضیح میدهیم و در بخشهای بعدی انواع پیوندهای کووالانسی را نیز شرح خواهیم داد. پیش از اینکه وارد این مبحث شویم، پیشنهاد میکنیم برای درک بهتر مفاهیمی مانند ابر الکترونی و ساختار اتم، مطلب «مدل کوانتومی اتم چیست؟ – به زبان ساده» از مجله فرادرس را مطالعه کنید.
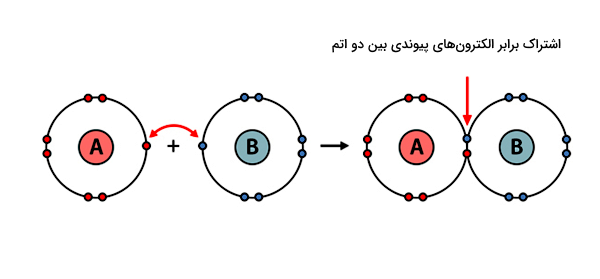
در سادهترین توصیف برای پیوند کووالانسی، یک یا تعداد بیشتری الکترون از هر اتم به سمت فضای بین دو هسته اتمی کشیده میشوند. به عبارتی این الکترونها بین دو اتم به اشتراک گذاشته میشوند. پیوند کووالانسی معمولا بین اتمهای یک ماده غیرفلزی مثل آب (H2O) یا آمونیاک (NH3) دیده میشود و در کل نسبت به دیگر انواع پیوندهای شیمیایی، رایجتر است. اکثر مولکولهای برپایه کربن مانند DNA یا پروتئینها بر اثر تشکیل پیوندهای کووالانسی ساخته میشوند.
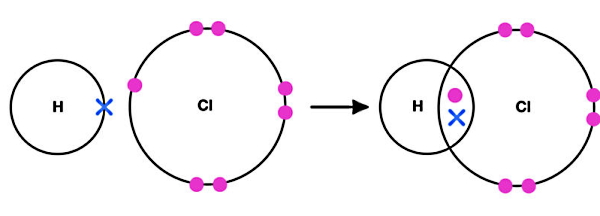
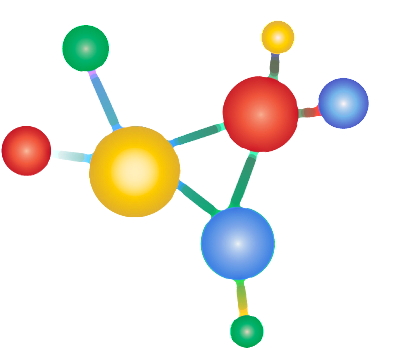
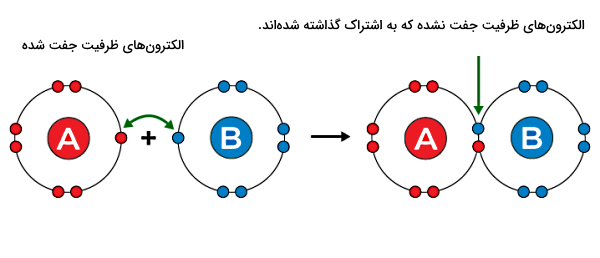
برای مثال، یک اتم هیدروژن و یک اتم کلر برای تشکیل مولکول هیدروژن کلرید (HCl) پیوند کووالانسی با هم تشکیل میدهند. در سمت چپ شکل بالا، یک اتم هیدروژن با یک الکترون ظرفیت (علامت ضربدر آبی) و یک اتم کلر با هفت الکترون ظرفیت (دایرههای صورتی) به هم نزدیک میشوند. در پیوند کووالانسی تعداد الکترونهایی که هر اتم به اشتراک میگذارد، با دیگری برابر است.
هیدروژن فقط یک الکترون ظرفیت برای به اشتراکگذاری با کلر دارد. کلر نیز از هفت الکترون ظرفیت خود، فقط یک الکترون جفتنشده خود را با هیدروژن به اشتراک میگذارد. در سمت راست تصویر، پیوند کووالانسی بین دو اتم نشان داده شده است که بر اثر وجود دو الکترون در فضای مشترک بین دو هسته شکل گرفته است. این دو الکترون را الکترونهای پیوندی مینامند.
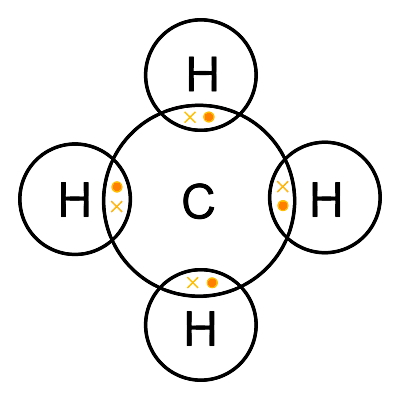
پیوندهای تشکیلدهنده اکثر ترکیبات آلی، کووالانسی است. برای مثال در شکل زیر ترکیب آلی «متان» (Methane) با فرمول شیمیایی CH4 را مشاهده میکنید که در آن چهار اتم هیدروژن هر کدام با یک الکترون ظرفیت (علامت ضربدر)، چهار پیوند کووالانسی با یک اتم کربن ساختهاند. الکترون ظرفیت برای هر اتم کربن چهار است که در تصویر بهصورت چهار دایره زرد نشان داده شده است.
همانطور که اشاره شد، مثال معمول دیگر برای پیوند کووالانسی مولکول آب است که از دو اتم هیدروژن و یک اتم اکسیژن ساخته شده است. طبق شکل زیر، اکسیژن با ظرفیت شش (الکترونهای آبی)، دارای دو الکترون جفتنشده است که هر کدام با یک الکترون از یک اتم هیدروژن (الکترونهای سبز) به اشتراک گذاشته میشوند و به این ترتیب، مولکول آب تشکیل میشود.
پیوندهای کووالانسی اغلب به شکلگیری مولکولهایی منجر میشوند که خود این مولکولها، با نیروهای خیلی ضعیفتری نسبت به پیوند کووالانسی کنار هم قرار میگیرند تا مایعات یا جامدات را بسازند. چنین پیوندهای بینمولکولی ضعیفی باعث تشکیل موادی مثل روغنها یا موم میشوند که دارای ساختاری حجیم و نرم با نقطه ذوب پاییناند.
| شبکه ساخته شده بر اساس پیوند کووالانسی | مولکول ساخته شده بر اساس پیوند کووالانسی |
| نقطه ذوب خیلی خیلی بالا | نقطه ذوب خیلی پایین |
| نقطه جوش خیلی خیلی بالا | نقطه جوش خیلی پایین |
| در حالت جامد رسانایی الکتریکی ندارد. | در حالت جامد رسانایی الکتریکی ندارد. |
| در حالت مایع رسانایی الکتریکی ندارد. | در حالت مایع رسانایی الکتریکی ندارد. |
اما طبق جدول بالا، در دو حالت ساختارهای تشکیل شده با پیوند کووالانسی ممکن است در جهتهای خاصی محکم و سخت باشند و در نتیجه، دمای ذوب بالایی نیز داشته باشند:
- تشکیل زنجیرهای طولانی از اتمها در مولکولهای بزرگ توسط پیوند کوالانسی (انواع پلیمرها مثل نایلون)
- تشکیل شبکهای از پیوند کووالانسی در جامداتی که متشکل از مولکولهای مجزا نیستند (الماس، کوارتز و کانیهای سیلیکات در بسیاری از سنگها)
هر چه تعداد الکترونهای به اشتراک گذاشته شده بین دو اتم بیشتر باشد، پیوند کووالانسی تشکیل شده قویتر است. یکی از دستهبندیهای پیوند کووالانسی، بر اساس تعداد الکترونهای به اشتراک گذاشته شده توسط هر اتم است که در بخشهای بعدی به این مبحث خواهیم پرداخت.
پیوند یونی
در گروه دیگر از انواع پیوندهای شیمیایی به نام پیوند یونی بهجای اشتراک الکترون، انتقال کامل الکترون داریم. در این پیوند، بیرونیترین اوربیتال یکی از اتمها (مثلا اتم B در شکل زیر) دارای جای خالی است و این امکان وجود دارد تا یک الکترون به این اوربیتال اضافه شود. طی فرآیند انتقال الکترون، یک اتم (اتم A) دارای بار مثبت و دیگری (اتم B) دارای بار منفی خواهد شد. در نتیجه، پیوند یونی بر اثر جاذبه الکتروستاتیکی بین یون مثبت و منفی ایجاد میشود.
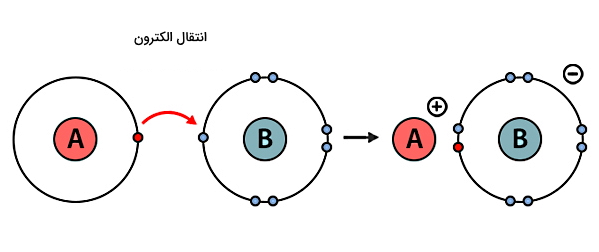
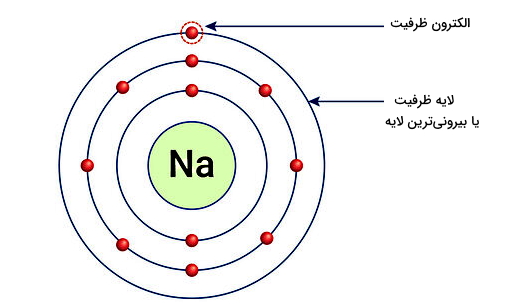
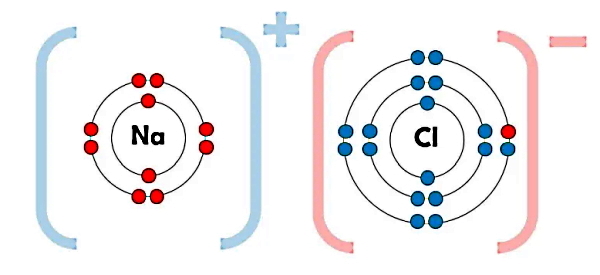
بهطور کلی دو نوع یون داریم. اتمی که الکترون از دست میدهد، به یون مثبت یا «کاتیون» (Cation) و اتمی که الکترون بهدست میآورد، به یون منفی یا «آنیون» (Anion) تبدیل میشود. برای مثال در شکل زیر اتم سدیم (Na) را با عدد اتمی ۱۱ به معنای اینکه این اتم دارای ۱۱ الکترون در تمام اوربیتالهای خود است، در نظر بگیرید. از این ۱۱ الکترون، ۲ الکترون لایه اول را که شامل تک اوربیتال s است، کامل پر میکنند. در لایه دوم نیز اوربیتال s با ۲ الکترون و سه اوربیتال p با ۶ الکترون کامل پر میشوند. پس تا اینجا ۱۰ الکترون در لایه اول و دوم قرار گرفتند.
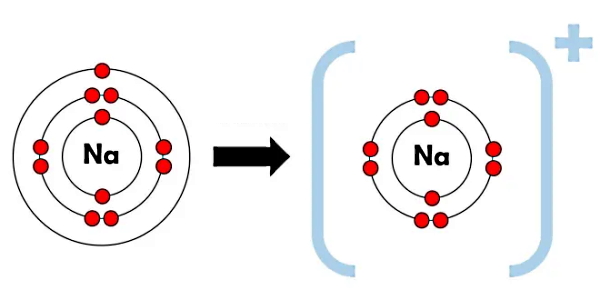
بنابراین تنها الکترون باقی مانده از ۱۱ الکترون، در لایه سوم یا n=3 و در اوربیتال s قرار میگیرد و همین تک الکترون باعث میشود اتم سدیم ناپایدار باشد. در شرایطی که امکان برقراری پیوند باشد، اتم سدیم مطابق شکل بالا با از دست دادن این تک الکترون از بیرونیترین لایه خود به کاتیون سدیم (+Na) تبدیل میشود. کاتیون سدیم همانطور که در شکل مشخص است، دارای لایههای الکترونی کاملا پر است.
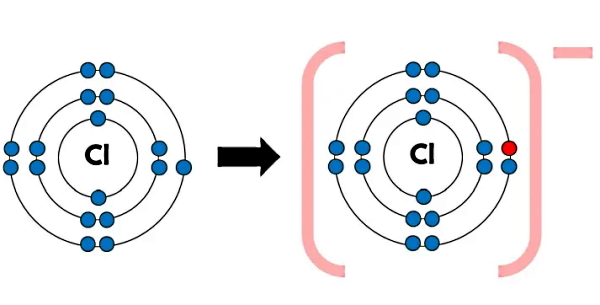
بنابراین اتم سدیم با تبدیل شدن به کاتیون سدیم در یک پیوند یونی به پایداری میرسد و به علت از دست دادن یک تک الکترون، دارای بار مثبت خواهد شد. به همین ترتیب، اتم کلر (Cl) در تشکیل پیوند یونی با اتم سدیم، با بهدست آوردن آن تک الکترون به آنیون کلر (–Cl) یا کلرید، تبدیل میشود. اتم کلر با عدد اتمی ۱۷ با بهدست آوردن یک الکترون، دارای آرایش الکترونی کاملی طبق شکل بالا خواهد شد.
پیوند یونی معمولا بین یک فلز مثل سدیم (Na) و نافلز مثل کلر (Cl) شکل میگیرد، به گونهای که اتم فلز الکترون از دست میدهد و به کاتیون تبدیل میشود در حالی که اتم غیرفلزی الکترون میگیرد و آنیون میشود. تشکیل پیوند یونی باعث میشود بلورهای نمکهای معدنی مثل نمک طعام یا کلرید سدیم (NaCl) دارای خصوصیات فیزیکی ویژهای باشند.
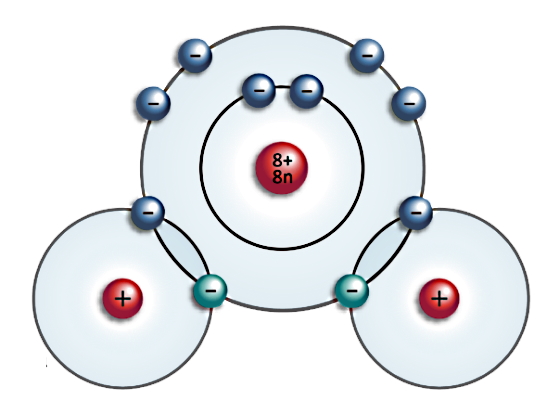
ساختاری که بر اساس پیوند یونی تشکیل شود را بلور یا کریستال یونی مینامیم. در شکل زیر یک بلور یونی نوعی نشان داده شده است که در آن شبکهای سه بعدی از آنیونها و کاتیونها با دو رنگ متفاوت نمایش داده شده است. چون تعداد کاتیونها و آنیونها در یک بلور یونی برابر است، پس مهم نیست کدام رنگ متعلق به کدام ذره است. نکته مهم این است که در یک بلور یونی، هر یون با یونهایی با بار مخالف خودش احاطه شده و یک ساختار منظم را شکل داده است.
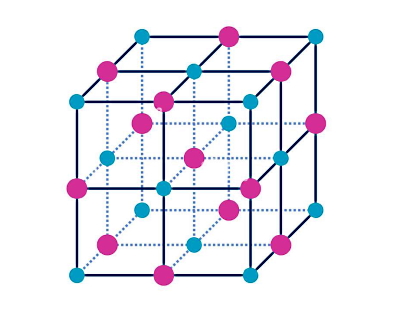
شبکه بلوری یونی متشکل است از تعداد زیادی از پیوندهای یونی بین کاتیونها و آنیونهایی که توسط نیروهای جاذبه الکتروستاتیکی در کنار هم قرار میگیرند، به این صورت که طبق قانون کولن بارهای همنام یکدیگر را دفع و بارهای ناهمنام یکدیگر را جذب میکنند.
پیوند یونی یک پیوند شیمیایی قوی محسوب میشود، بنابراین ساختارهای تشکیل شده بر این اساس حالت جامد ماده هستند و به دمای ذوب بالایی نیاز دارند. اما پیوند یونی در عین قوی بودن، شکننده نیز هست. علت این مسئله این است که نیروهای بین یونها کوتاهبرد هستند و نمیتوانند بین ترکها و شکستگیها به آسانی پل بزنند. در مقایسه با پیوند کووالانسی، تشکیل پیوند یونی و انتقال کامل الکترون از یک اتم به اتم دیگر فقط برای تعداد محدودی از عناصر امکانپذیر است. بنابراین همانطور که قبلا هم اشاره کردیم، بیشتر پیوندهای شیمیایی از نوع کووالانسی هستند تا یونی.
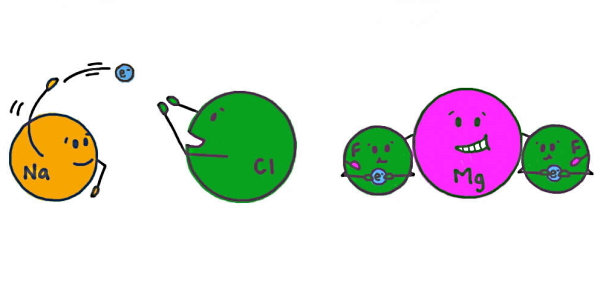
در سمت راست شکل بالا همانطور که از به اشتراکگذاری الکترونها مشخص است، پیوندهای بین اتم منیزیم (Mg) و دو اتم فلوئور (F) در ترکیب MgF2 کووالانسی است. در حالی که در سمت چپ تصویر انتقال الکترون از سدیم به کلر پیوند یونی ایجاد کرده است. ذوب یک بلور یونی جامد و تبدیل آن به حالت مایع، با شکستن پیوندهای یونی و سپس حرکت آزادانه ذرات باردار اتفاق میافتد. علت اینکه پس از تغییر حالت به مایع، یونها میتوانند آزادانه حرکت کنند این است که یونها دارای جهتگیری خاصی نبودهاند.
ترکیب پیوند یونی و کووالانسی
تا اینجا دو نوع از انواع پیوندهای شیمیایی، یعنی پیوند کووالانسی و پیوند یونی را آموختیم. ممکن است یک بلور یونی مخلوطی از پیوندهای یونی و کووالانسی باشد، مثل نمک اسیدهای پیچیده مانند سیانید سدیم (NaCN). تکنیک پراش اشعه ایکس نشان میدهد که در این ترکیب پیوند بین کاتیونهای سدیم (+Na) و آنیونهای سیانید (–CN) یونی هستند.
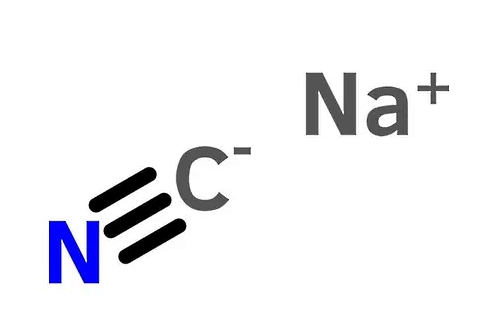
از طرفی، پیوند بین اتمهای کربن (C) و نیتروژن (N) در سیانید از نوع کووالانسی است. زمانی که یک بلور یونی مانند سیانید سدیم در آب حل میشود، پیوندهای یونی آن در اثر برهمکنش با آب میشکنند، اما پیوندهای کووالانسی حفظ میشوند.
پیوند فلزی
تا اینجا آموختیم که پیوند کووالانسی و پیوند یونی بهعنوان دو مورد از انواع پیوندهای شیمیایی، چگونه تشکیل میشوند. یکی از پیوندهایی که کمتر در مورد آن صحبت میشود، پیوند فلزی است. در این پیوند، هر اتم فلزی یک یا تعداد بیشتری الکترون را به دریای الکترون میدهد. دریای الکترون فضایی پر از الکترون است که بین تعداد زیادی اتم در فلز تشکیل میشود و در آن، هر الکترون آزاد است تا با تعداد زیادی اتم برهمکنش داشته باشد. به عبارت دیگر در یک فلز، الکترونهای دریای الکترون متعلق به هیچ اتم خاصی نیستند.
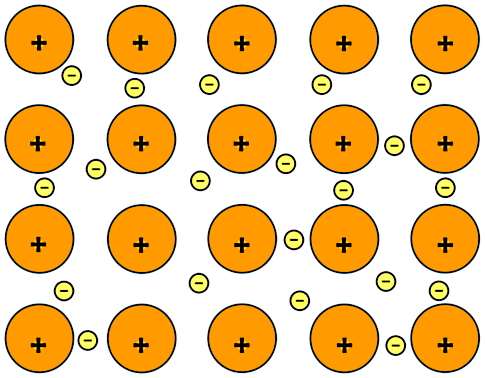
طبق شکل بالا در یک پیوند فلزی، اتمهای فلز با از دست دادن الکترون دارای بار مثبت میشوند (ذرات نارنجی رنگ دارای بار مثبتاند). همچنین الکترونهایی که از اتمهای فلز خارج شدهاند (ذرات زرد رنگ کوچک)، آزادانه بین یونهای مثبت در فلز در حال حرکت هستند. نیروی الکتروستاتیکی جاذبه بین یونهای مثبت و الکترونهای دریای الکترون پیوند فلزی را ایجاد میکند.
پیوند فلزی همان پیوند بین اتمهای یک عنصر فلزی است. میدانیم تمام اتمهای یک عنصر از یک نوع هستند. برای مثال پیوند بین اتمهای عناصر فلزی مثل مس (Cu)، نقره (Ag)، روی (Zn) و آلومینیم (Al) از نوع فلزی است. همچنین پیوند بین اتمها در مخلوطی از دو یا چند عنصر یا یک «آلیاژ» (Alloy) نیز از نوع فلزی است. در شکل زیر پیوند فلزی برای دو عنصر منیزیم (Mg) و سدیم (Na) نشان داده شده است. عدد اتمی منیزیم ۱۲ و ظرفیت آن ۲ است.
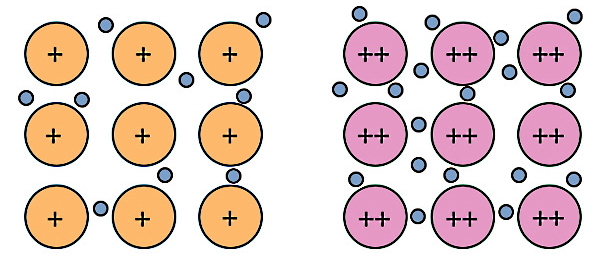
بنابراین در عنصر منیزیم یا فلز منیزیم، هر اتم منیزیم برای رسیدن به پایداری با از دست دادن ۲ الکترون و تبدیل به یون مثبت یا کاتیون 2+Mg، پیوند فلزی تشکیل میدهد. به محض اینکه هر اتم منیزیم الکترون از دست میدهد، این الکترونها وارد دریای الکترون در فلز میشوند و دیگر متعلق به اتم خاصی نیستند. در مورد سدیم چون ظرفیت این اتم برابر با ۱ است، پس هر اتم فقط یک الکترون از دست میدهد و کاتیون سدیم دارای یک بار مثبت خواهد شد.
پیوند فلزی اغلب یک پیوند قوی است که موجب استحکام کششی در فلزات میشود. چنین پیوندی باعث میشود بلورهای فلزی به راحتی دچار تغییر شکل شوند. علت این است که بلورهای فلزات از اتمهایی ساخته شدهاند که جذب هم میشوند، اما نه در هر جهتگیری خاصی. بنابراین فلزات دارای خاصیت چکشخواریاند.
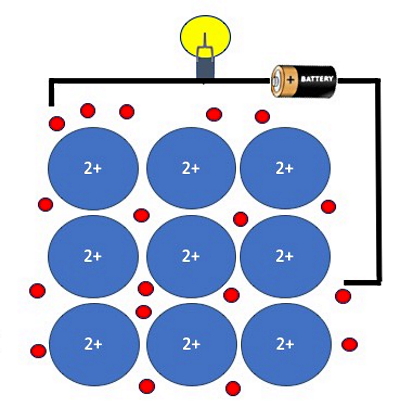
همچنین تشکیل دریای الکترون در پیوند فلزی عاملی است که باعث میشود تا فلزات رساناهای حرارتی و الکتریکی خوبی محسوب شوند و دارای درخشندگی بالایی نیز باشند، طوری که بیشتر فرکانسهای نور سفید را منعکس کنند. در واقع این حرکت آزادانه الکترونهاست که منجر به بروز چنین خواصی در فلزات میشود. شکل بالا داخل یک سیم رسانا از جنس منیزیم را نشان میدهد. الکترونهای آزاد در دریای الکترون منیزیم، مسئول انتقال جریان و در نتیجه رساندن جریان الکتریکی به لامپ در مدار الکتریکی هستند.
تفاوت پیوند کووالانسی، یونی و فلزی
خوب است که پیش از ورود به مبحث بعدی، ابتدا مقایسهای بین انواع پیوندهای شیمیایی بین اتمها شامل پیوند کووالانسی، یونی و فلزی داشته باشیم. اگر به خاطر داشته باشید، در پیوند کووالانسی و یونی دو نوع اتم مختلف با به اشتراک گذاشتن یا انتقال الکترون با هم پیوند تشکیل میدادند. پیوند کووالانسی هم بین اتمهای مختلف (CN) و هم بین اتمهایی کاملا مشابه (N2) ممکن است ایجاد شود اما پیوند یونی فقط بین اتمهای متفاوت (CaO) شکل میگیرد.
تفاوت خیلی مهم پیوند فلزی با انواع پیوندهای شیمیایی دیگر این است که این پیوند بین دو اتم متفاوت ایجاد نمیشود. پیوند یونی اتمهای فلز را به اتمهای نافلز متصل میکند، پیوند کووالانسی بین اتمهای نافلز شکل میگیرد و پیوند فلزی بین اتمهای یک فلز در یک «شبکه حجیم» (Bulk) برقرار میشود.
| پیوند فلزی | پیوند یونی | پیوند کووالانسی |
| نحوه تشکیل پیوند: تشکیل دریای الکترون | نحوه تشکیل پیوند: انتقال الکترون | نحوه تشکیل پیوند: اشتراک الکترون |
| حاصل پیوند: عنصر فلزی | حاصل پیوند: بلور جامد شامل کاتیون و آنیون | حاصل پیوند: معمولا مایع یا جامد |
| اجزای پیوند: اتمهای فلز | اجزای پیوند: اتم فلز + اتم نافلز | اجزای پیوند: اتم نافلز + اتم نافلز |
| رسانایی الکتریکی ترکیب: زیاد | رسانایی الکتریکی ترکیب: متوسط و فقط با حل شدن در آب | رسانایی الکتریکی ترکیب: ندارد |
| نقطه جوش و ذوب: معمولا بالا | نقطه جوش و ذوب: خیلی بالا | نقطه جوش و ذوب: خیلی پایین |
در جدول بالا ویژگیهای مختلف این سه نوع پیوند بهصورت خلاصه بیان شده است. دقت کنید که برای پیوند کووالانسی، فقط مولکول تشکیل شده از این پیوند را در نظر گرفتهایم و خواص بیان شده مربوط به شبکهای از پیوندهای کووالانسی نیست. همچنین منظور از الکترونهای اشتراکی، انتقالی یا الکترونهایی که به دریای الکترون داده میشوند، الکترونهای ظرفیت است.
انواع پیوندهای کووالانسی
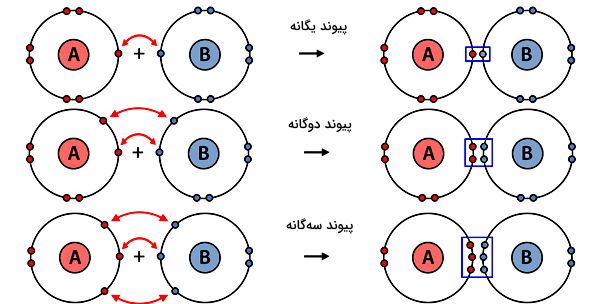
پس از توضیح انواع پیوندهای شیمیایی بین اتمها شامل پیوند کووالانسی، یونی و فلزی، در این بخش میخواهیم انواع پیوندهای شیمیایی کووالانسی را توضیح دهیم. گفتیم در پیوند کووالانسی تعدادی الکترون به اشتراک گذاشته میشوند، اما اینکه تعداد این الکترونها چقدر باشد و به کدام اتم نزدیکتر باشند، باعث میشود پیوند کووالانسی را در گروهبندی پیوندهای «یگانه» (Single) یا «چندگانه» (Multiple) و «قطبی» (Polar) یا «غیرقطبی» (Nonpolar) قرار دهیم.
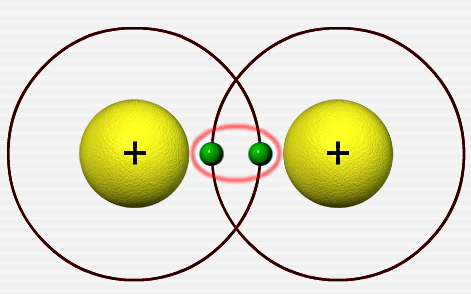
پیوند کووالانسی یگانه
یکی از انواع پیوندهای شیمیایی کووالانسی، پیوند یگانه است. پیوند یگانه به پیوند کووالانسی بین دو اتم که هر کدام فقط یک الکترون به اشتراک گذاشتهاند، گفته میشود. برای مثال اتم هیدروژن (H) را که دارای یک الکترون ظرفیت است، در نظر بگیرید. هر یک از دو اتم هیدروژن میتوانند با به اشتراک گذاشتن یک الکترون و تشکیل یک پیوند کووالانسی یگانه توسط این جفت الکترون اشتراکی، یک مولکول هیدروژن (H2) را بسازند.
پیوند کووالانسی چندگانه
در پیوند چندگانه، هر اتم بیشتر از یک الکترون به اشتراک میگذارد. بنابراین تعداد الکترونهای مشترک برابر با چهار عدد یا بیشتر خواهد بود. اگر دو جفت الکترون مشترک باشند، پیوند «دوگانه» (Double)، اگر سه جفت الکترون اشتراکی داشته باشیم پیوند «سهگانه» (Triple) و به همین ترتیب، نامگذاری پیوندهای چهارگانه و بالاتر نیز انجام میشود.
برای مثال، در سمت راست تصویر زیر نحوه تشکیل پیوند کووالانسی سه گانه در مولکول دیفسفر یا P2 نشان داده شده است. هر اتم فسفر که با P نشان داده میشود، دارای عدد اتمی ۱۵ و ۵ الکترون ظرفیت در بیرونیترین لایه خود است. اگر دو اتم فسفر برای تشکیل پیوند به هم نزدیک شوند، هر اتم با به اشتراکگذاری ۳ الکترون جفتنشده خود طبق شکل زیر، سه پیوند کووالانسی یگانه یا یک پیوند کووالانسی سهگانه را میسازد.
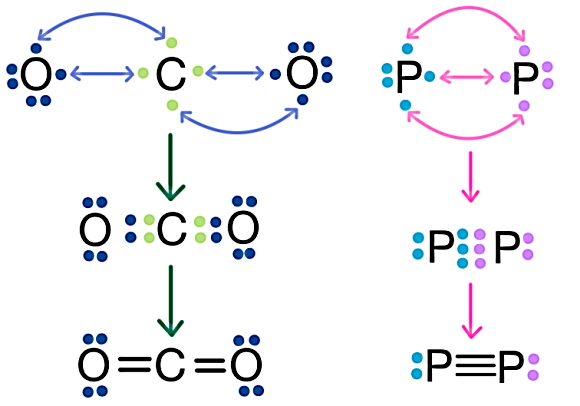
سمت چپ تصویر بالا، نحوه شکلگیری مولکول دی اکسیدکربن یا CO2 را نشان میدهد. این مولکول متشکل است از یک اتم کربن با ظرفیت ۴ و دو اتم اکسیژن با ظرفیت ۶. در قسمت بالای شکل، تعداد الکترونهای ظرفیت هر اتم را پیش از تشکیل پیوند به صورت نقطههایی دور نماد شیمیایی اتم مشاهده میکنید. اگر هر اتم اکسیژن دو الکترون خود را با اتم کربن به اشتراک بگذارد، به این ترتیب کربن چهار الکترون ظرفیت خود را در پیوند قرار داده است و کاملا به پایداری میرسد. بین هر اتم اکسیژن با اتم کربن، دو پیوند کووالانسی یگانه یا یک پیوند کووالانسی دوگانه ایجاد میشود. پس در مولکول دیاکسیدکربن، دو پیوند دوگانه داریم.
پیوند کووالانسی قطبی
تا اینجا انواع پیوندهای شیمیایی کووالانسی را از نظر تعداد الکترونهای به اشتراک گذاشته شده، یاد گرفتیم. در این بخش و بخشهای بعدی میخواهیم پیوندهای کووالانسی را از نظر قطبیت بشناسیم. در یک پیوند کووالانسی قطبی، یک یا تعداد بیشتری الکترون بین دو هسته بهصورت نابرابری به اشتراک گذاشته میشوند.
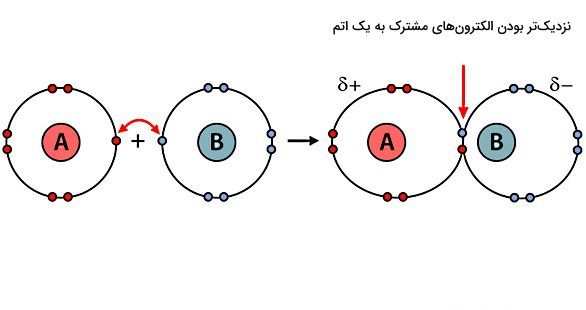
منظور از نابرابر بودن این است که الکترونهای به اشتراک گذاشته شده به یکی از اتمها نزدیکتر هستند و در نتیجه، تعادل بار در دو طرف مولکول ساخته شده بهم میخورد و قطبش داریم. در شکل بالا قطبی بودن پیوند کووالانسی تشکیل شده با ایجاد بار مثبت و منفی روی هر اتم مشخص شده است. علامت دلتا (δ) نشاندهنده مقدار بار خیلی خیلی کوچک است.
عدم تعادل بار در پیوند قطبی باعث میشود که ماهیت چنین پیوندی به پیوند یونی خیلی نزدیک باشد. بنابراین باید دقت کنیم که این دو پیوند با هم اشتباه نشوند. اگر بخواهیم چند نمونه مولکول دارای پیوند کووالانسی قطبی یا مولکول قطبی مثال بزنیم، میتوانیم به آب و آمونیاک اشاره کنیم. در مولکول آب هر دو پیوند بین اتم هیدروژن و اکسیژن قطبی است.
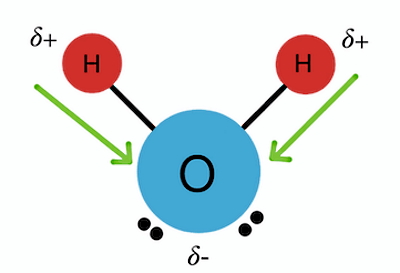
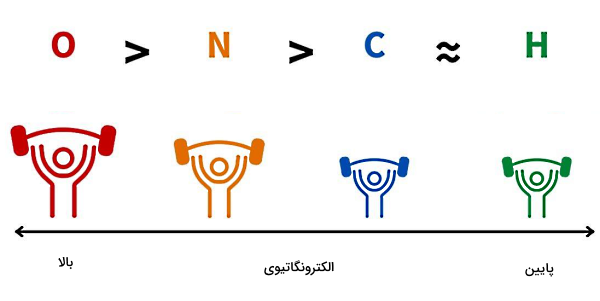
برای درک بهتر اینکه چرا الکترونهای مشترک به هسته یک اتم نزدیکتر میشوند و مولکول قطبی میشود، ابتدا باید مفهوم «الکترونگاتیوی» (Electronegativity) را بشناسیم. الکترونگاتیوی برابر است با میزان تمایل یک اتم برای کشیدن یک جفت الکترون به سمت هسته خود. پس قطبی شدن یک مولکول، به میزان اختلاف الکترونگاتیوی اتمهای سازنده آن مولکول بستگی دارد. برای مثال در مورد مولکول آب طبق شکل زیر، الکترونگاتیوی اتم اکسیژن از اتم هیدروژن خیلی بیشتر است.
بنابراین اکسیژن جفت الکترونهای اشتراکی را به سمت هسته خود میکشد. با نزدیک شدن جفت الکترونها به اکسیژن، بار اکسیژن منفی میشود و با دور شدن جفت الکترونها از هسته دو اتم هیدروژن، این دو اتم روی هم بار مثبتی برابر با اندازه بار اکسیژن بهدست میآورند. پس عامل تعیینکننده در قطبی بودن یک پیوند کووالانسی، میزان اختلاف الکترونگاتیوی اتمهای آن پیوند است. برای اطلاع از میزان الکترونگاتیوی هر اتم، میتوانید از اطلاعات جدول تناوبی عناصر استفاده کنید.
پیوند کووالانسی داتیو
پیوند «داتیو یا کئوردینانسی» (Coordinate or Dative) نوع دیگری از پیوند کووالانسی بین دو اتم است که در آن دو الکترون از یک اتم به اوربیتال اتم دیگر وارد میشوند. بنابراین با توجه به تعریف پیوند قطبی، حتی میتوانیم بگوییم پیوند داتیو قطبیت بیشتری از پیوند قطبی معمول دارد و به همین علت آن را «دوقطبی» (Dipolar) نیز مینامند. در این پیوند دو الکترون پیوندی مربوط به یک اتم است، بنابراین این اتم با از دست دادن الکترون به کاتیون تبدیل خواهد شد.
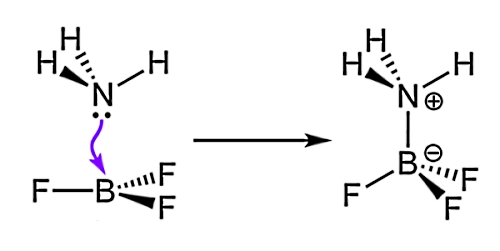
پس در پیوند داتیو یک اتم دو الکترون خود را به اشتراک میگذارد. برای مثال ترکیب آمونیاک (NH3) و تریفلورید بور (BF3) برای تشکیل نوعی کمپلکس شیمیایی، با برقراری یک پیوند داتیو بین N و B انجام میشود که در آن یک جفت الکترون پیوندی از اتم نیتروژن با اوربیتال اتمی خالی بور به اشتراک گذاشته میشود. به این ترتیب، BF3 با داشتن اوربیتال اتمی خالی جهت دریافت جفت الکترون، الکترونپذیرنده و NH3 با داشتن یک جفت الکترون قابل اشتراکگذاری الکتروندهنده نامیده میشوند.
پیوند کووالانسی غیرقطبی
یکی دیگر از انواع پیوندهای کووالانسی، پیوند غیرقطبی است. برخلاف پیوند قطبی، در پیوند غیرقطبی الکترونهای پیوندی بهصورت مساوی بین دو اتم به اشتراک گذاشته میشوند و به اتم خاصی نزدیک نیستند. با توجه به تاثیر الکترونگاتیوی در قطبیدگی مولکولهای کووالانت، انتظار داریم برای تشکیل یک مولکول غیرقطبی دو اتم با الکترونگاتیوی نزدیک با هم پیوند تشکیل دهند.
برای نمونه مولکولهای اکسیژن (O2) یا متان (CH4) غیرقطبی محسوب میشوند. در مولکول اکسیژن هر دو اتم اکسیژن هستند، پس اختلاف الکترونگاتیوی بین دو اتم تشکیلدهنده پیوند صفر است. بر این اساس، هر مولکولی که از دو اتم یکسان ساخته شده باشد، غیرقطبی است.
در مولکول متان نیز، الکترونگاتیوی اتم کربن (۲٫۵۵) بسیار نزدیک به الکترونگاتیوی اتم هیدروژن (۲٫۲) است. در این قسمت میخواهیم در مورد پیوندهای متان با جزئیات بیشتری توضیح دهیم. طبق مطالبی که در بخش اول راجعبه آرایش الکترونی گفتیم، اتم کربن با عدد اتمی ۶ و ظرفیت ۴ آرایش الکترونی به شکل زیر خواهد داشت:
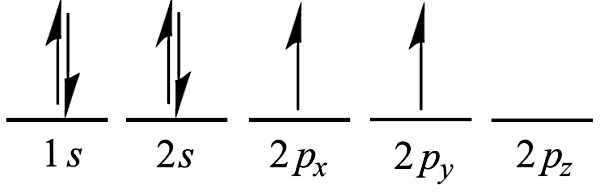
پس کربن برای پر کردن لایه ظرفیت خود و پایداری بیشتر، به ۴ الکترون نیاز دارد. کربن در متان، این چهار الکترون را از طریق تشکیل پیوند با چهار اتم هیدروژن تامین میکند. بنابراین دو عدد از این الکترونها با دو الکترونی که در 2px و 2py هست، جفت میشوند و دو عدد در اوربیتال 2pz قرار میگیرند. از طرف دیگر، هر اتم هیدروژن هم به یک الکترون در پوسته بیرونی خود نیاز دارد تا بتواند بیرونیترین لایه خود را تکمیل کند و پایدار شود.

بنابراین یک اتم کربن و چهار اتم هیدروژن با به اشتراکگذاری الکترونهای ظرفیت خود و تشکیل پیوندهای کووالانسی غیرقطبی، چهار اتم هیدروژن و یک اتم کربن پایدارتر خواهند شد. مولکولهایی که از پیوندهای کووالانسی غیرقطبی ساخته میشوند یا مولکولهای غیرقطبی، اغلب غیرقابل مخلوط شدن با آب یا سایر حلالهای قطبی هستند. اما حلالیت خیلی خوبی در حلالهای غیرقطبی مانند «هگزان» (Hexane) دارند.
پیوندهای بینمولکولی
تا اینجا با انواع پیوندهای شیمیایی درونمولکولی یعنی پیوندهایی که بین اتمهای یک مولکول یا اتمهای یک عنصر برقرار میشوند، آشنا شدیم. پیوند بینمولکولی، پیوندی است که بین دو یا چند مولکول ایجاد میشود و همانطور که در ابتدای این مطلب گفته شد، نسبت به پیوندهای درونمولکولی بسیار ضعیفتر است. بنابراین این پیوند از جنس پیوندهای قوی بین اتمی مانند پیوند کووالانسی یا پیوند یونی نیست.
تشکیل پیوند بینمولکولی باعث ایجاد نیروهای بینمولکولی از جنس نیروهای الکترومغناطیسی جاذبه یا دافعه بسیار کوتاهبردی بین مولکولها میشود. این نیروها روی شکلگیری خواص فیزیکی ماده مانند دمای ذوب، دمای جوش، چگالی و آنتالپی آن موثراند. تقسیمبندی اصلی انواع پیوندهای شیمیایی بینمولکولی به شکل زیر است:
- پیوند هیدروژنی
- برهمکنش یون با دوقطبی القایی
- برهمکنش یون با دوقطبی
- نیروی واندروالسی
برای مثال نیروی جاذبه بین مولکولهای غیرقطبی گازهای نجیب، از نوع نیروی واندروالسی است. در دستهبندی بالا، خود نیروی واندروالسی که نوعی برهمکنش بینمولکولی است، به موارد زیر تقسیم میشود:
- نیروی پراکندگی لاندن
- برهمکنش دوقطبی – دوقطبی
- «نیروی کیسوم» (Keesom Force)
- «نیروی دبای» (Debye Force)
در ادامه این مطلب، از انواع پیوندهای شیمیایی بینمولکولی به معرفی پیوند هیدروژنی، نیروی پراکندگی لاندن و برهمکنش دوقطبی – دوقطبی خواهیم پرداخت. پیوند ضعیف هیدروژنی و نیروی پراگندگی لاندن که هم اتمها و هم مولکولها را به هم متصل میکنند، اغلب در ساختارهای زیستشناسی دیده میشوند. با اینکه این دو پیوند در مقایسه با سایر پیوندهای شیمیایی ضعیفتراند، اما برای مثال این پیوند هیدروژنی است که باعث میشود ساختار پروتئینها و DNA پایدار بماند.
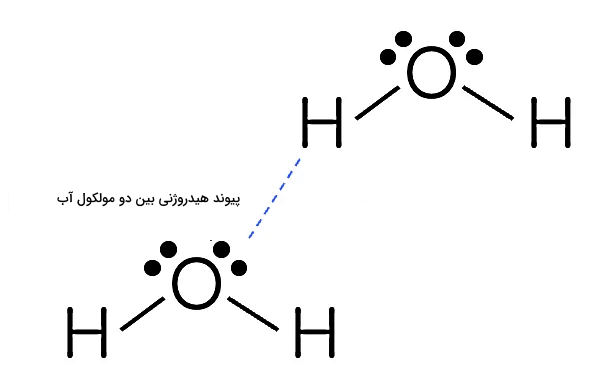
پیوند هیدروژنی
یکی از مهمترین انواع پیوندهای شیمیایی بینمولکولی، پیوند هیدروژنی است و همانطور که گفتیم، این پیوند علیرغم قدرت کم، اثر مهمی روی خواص فیزیکی مواد دارد. برای مثال، علت دمای جوش بالا در موادی مثل آب و آمونیاک، پیوند هیدروژنی است. شکل زیر نحوه تشکیل پیوند هیدروژنی بین دو مولکول فرضی AH و BC را نشان میدهد.
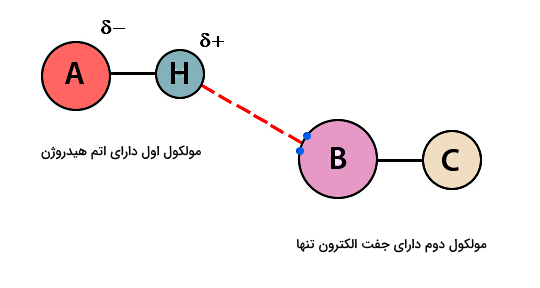
نکته: برای ایجاد پیوند هیدروژنی لازم است یکی از مولکولها دارای اتم هیدروژن (H) و مولکول دیگر دارای یک جفت الکترون تنها باشد.
پیوند هیدروژنی در شکل بالا به شکل زمانی تشکیل میشود که دو اتم A و B هر دو دارای الکترونگاتیوی بالایی باشند (مثلا اتمهای F یا O یا N). نحوه تشکیل پیوند به این صورت است که ابتدا بین اتم A و H در مولکول اول، یک پیوند قطبی کووالانسی شکل میگیرد و در نتیجه اتم H دارای بار مثبت جزئی خواهد شد. از طرفی اتم B که در مولکول دوم دارای یک جفت الکترون تنها است، جذب این بار مثبت جزئی میشود و به این ترتیب پیوند هیدروژنی تشکیل میشود.
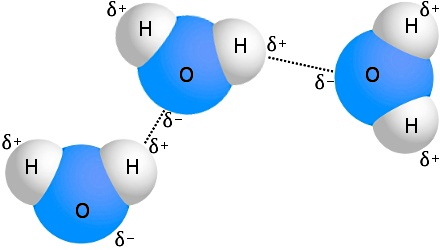
در واقع با تشکیل پیوند هیدروژنی بین یک اتم هیدروژن و یک اتم با الکترونگاتیوی بالا در مولکول همسایه، نیروی جاذبه از نوع هیدروژنی برقرار خواهد شد. همانطور که اشاره کردیم، قدرت پیوند هیدروژنی بهعنوان یک پیوند بینمولکولی از قدرت پیوند کووالانسی یا یونی کمتر است.
نیروی پراکندگی لاندن
همانند پیوند هیدروژنی، نیروهای پراکندگی لاندن هم نیروهای جاذبه ضعیفی هستند که بین مولکولها ایجاد میشوند. اما برخلاف پیوند هیدروژنی، این نوع پیوند میتواند بین هر نوع اتم یا مولکولی تشکیل شود و به عدم تعادل بار موقتی ایجاد شده در توزیع الکترونی بستگی دارد.
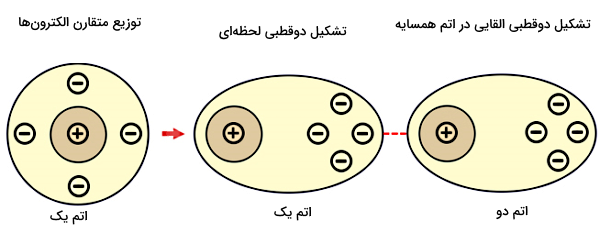
میخواهیم آخرین جملهای که بالا گفتیم را بیشتر توضیح دهیم. الکترونهای داخل یک اتم یا مولکول پیوسته در حال حرکتاند. بنابراین برای مثال، جمع شدن الکترونها در ناحیهای خاص از یک مولکول، باعث میشود باز جزئی منفی در یک بخش و بار جزئی مثبت در بخش دیگر مولکول ایجاد شود. ایجاد بارهای مخالف هم در دو بخش مجزای یک مولکول، تعادل بار را بهم میزند. حالا اگر یک مولکول به این شکل به مولکول دیگری با تعادل بار نزدیک شود، موجب خواهد شد که بارهای روی آن مولکول مجددا توزیع شوند. پس دو مولکول از لحاظ توزیع بار شبیه هم خواهند شد و دو بخش مثبت و منفی روی هر کدام دیگری را جذب میکند.
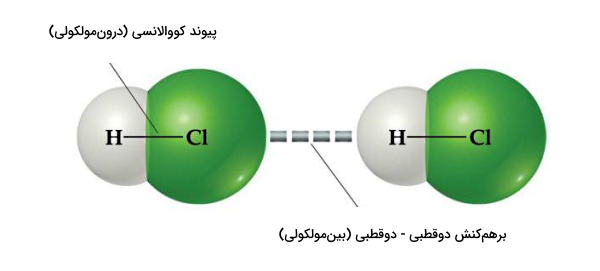
برهمکنش دوقطبی – دوقطبی
برهمکنش دوقطبی – دوقطبی زمانی ایجاد میشود که سر دارای بار مثبت جزئی (+δ) یک مولکول با سر دارای بار منفی جزئی (–δ) مولکول مجاور خود برهمکنش کند. بنابراین لازمه برقراری این نوع نیروی جاذبه این است که در دو مولکول مجاور هم، بارهای جزئی مخالف هم ایجاد شده باشند. برهمکنش دوقطبی – دوقطبی، قویترین پیوند بینمولکولی محسوب میشود.
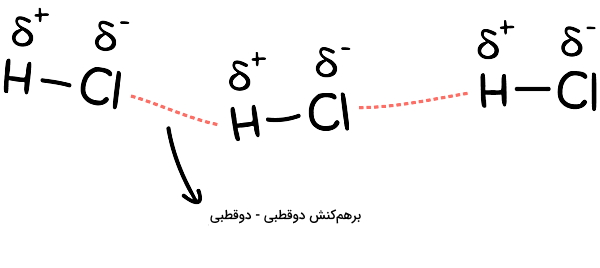
برای مثال، تشکیل پیوندهای کووالانسی قطبی داخل مولکولهای کلرید هیدروژن (HCl) را در نظر بگیرید. پیوند کووالانسی قطبی باعث میشود دو سر هر مولکول کلرید هیدروژن دارای بارهای مثبت و منفی جزئی (یا خیلی کوچک) شود. پس وقتی که این مولکولها کنار هم قرار بگیرند، نیروی جاذبه الکتروستاتیکی بین سر مثبت یک مولکول و سر منفی مولکول دیگر برهمکنش دوقطبی – دوقطبی را بهعنوان نیروی یک بینمولکولی قوی برقرار خواهد کرد. شکل بالا این برهمکنش را بین مولکولهای HCl توصیف میکند.
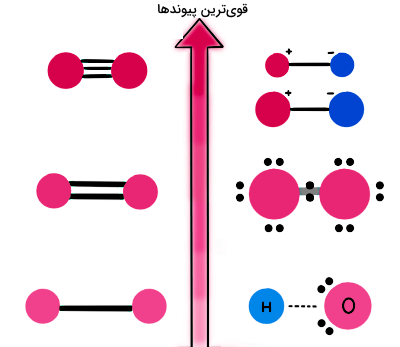
قدرت پیوندهای شیمیایی
پس از اینکه انواع پیوندهای شیمیایی را کامل یاد گرفتیم، حالا میخواهیم قدرت این پیوندها را مقایسه کنیم تا ببینیم قویترین پیوند شیمیایی کدام است. گفته بودیم که قویترین پیوندهای شیمیایی، نیروهای درونمولکولی هستند که باعث قرار گرفتن اتمها در کنار هم برای تشکیل یک مولکول میشوند. بنابراین میتوانیم نتیجهگیری کنیم که احتمالا یک پیوند قوی، حاصل انتقال یا به اشتراکگذاری الکترونها بین مراکز اتمی است و بر اساس جاذبه الکتروستاتیکی بین پروتونهای هسته و الکترونها شکل خواهد گرفت.
میزان قدرت پیوندها با توجه به اختلاف الکترونگاتیوی اجزای تشکیلدهنده آنها متفاوت است. همانطور که گفتیم، الکترونگاتیوی تمایل اتم یک عنصر شیمیایی برای جذب الکترونهای به اشتراک گذاشته شده است تا یک پیوند شیمیایی تشکیل شود. پس هرچه الکترونگاتیوی اتم بیشتر باشد، الکترون بیشتری جذب خواهد کرد. میتوانیم الکترونگاتیوی را بهعنوان کمیتی برای تخمین انرژی پیوندی در نظر بگیریم، به این صورت که اختلاف الکترونگاتیوی خیلی زیاد منجر به افزایش خاصیت قطبیدگی یا مشخصه یونی بودن پیوند خواهد شد.
با توجه به اندازه اختلاف الکترونگاتیوی اتمهای درگیر در یک پیوند، نمیتوانیم دقیقا مشخص کنیم که آیا پیوند یونی تشکیل میشود یا پیوند کووالانسی. اما به صورت تقریبی، اگر اختلاف الکترونگاتیوی بین دو اتم بالاتر از ۱٫۷ باشد، پیوند یونی و اگر اختلاف الکترونگاتیوی بین دو اتم کمتر از ۱٫۷ باشد، پیوند کووالانسی ایجاد میشود.
بنابراین در یک پیوند یونی به عنوان قویترین پیوند، نیروهای جاذبه الکتروستاتیکی بین اتمهایی با اختلاف الکترونگاتیوی بالا ایجاد میشوند. در پیوندهای کووالانسی غیرقطبی، اختلاف الکترونگاتیوی بین اتمهای پیوند، کم است (معمولا بین ۰ تا ۰٫۳)، در حالی که پیوندهای کووالانسی قطبی بین دو اتم با اختلاف الکترونگاتیوی متوسط (بین ۰٫۳ تا ۱٫۷) تشکیل میشوند.
تکمیل یادگیری انواع پیوندهای شیمیایی با فرادرس
اگر نیاز به اطلاعات کاملتری در مورد انواع پیوندهای شیمیایی و در سطوح دانشگاهی دارید، مشاهده فیلمهای آموزشی زیر از مجموعه فرادرس را به شما پیشنهاد میکنیم:

- فیلم آموزش شیمی عمومی فرادرس
- فیلم آموزش رایگان پیوند شیمیایی فرادرس
- فیلم آموزش رایگان پیوندهای شیمیایی در شیمی عمومی فرادرس
- فیلم آموزش شیمی عمومی ۱ و ۲ مرور و حل مساله فرادرس
آزمون انواع پیوندهای شیمیایی
در انتهای این مطلب از مجله فرادرس آموختیم که انواع پیوندهای شیمیایی به چه صورت تشکیل میشوند و بر چه اساسی تقسیمبندی شدهاند. اگر تمایل دارید دانش خود را در این زمینه محک بزنید، در این بخش آزمونی برای شما تهیه شده است که میتوانید پس از پاسخدهی به سوالات آن، با کلیک روی بخش «دریافت نتیجه آزمون» نمره نهایی خود را دریافت کنید.
در مولکول متان هر اتم کربن با … اتم هیدروژن پیوند … دارد.
گزینه دوم صحیح است. در مولکول متان با فرمول شیمیایی CH4، هر اتم کربن با چهار اتم هیدروژن چهار پیوند کووالانسی یگانه تشکیل میدهد.
در پیوند کووالانسی قطبی الکترونها بهصورت … و در پیوند کووالانسی غیرقطبی الکترونها بهصورت … به اشتراک گذاشته میشوند.
برابر – نابرابر
نابرابر – نابرابر
نابرابر – برابر
گزینه آخر درست است. در پیوند کووالانسی قطبی به علت به اشتراکگذاری نابرابر الکترونها و نزدیکی جفت الکترون به هسته یک اتم، قطبیت ایجاد میشود. در حالی که در پیوند غیرقطبی الکترونها بین دو هسته به شکل مساوی توزیع میشوند.
پیوند شیمیایی بین یک اتم سولفور یا گوگرد (S) با الکترونگاتیوی ۲٫۵ و دو اتم کلر (Cl) با الکترونگاتیوی ۳ کدام گزینه است؟
پیوندی بین این دو نوع اتم ایجاد نمیشود.
پیوند کووالانسی قطبی
پیوند کووالانسی غیرقطبی
گزینه دوم صحیح است. اتم گوگرد دارای دو الکترون جفتنشده در لایه ظرفیت خود است. هر کدام از این دو الکترون با یک الکترون جفتنشده از هر اتم کلر به اشتراک گذاشته میشوند.
بنابراین تشکیل پیوند کووالانسی برای این ترکیب امکانپذیر است. به علت وجود اختلاف بین الکترونگاتیوی این دو اتم، پیوندهای کووالانسی هر دو قطبی محسوب میشوند.
در کدام گزینه الکترونها متعلق به هیچ اتمی خاصی نیستند؟
الکترونهای منتقل شده از کاتیون به آنیون در یک پیوند یونی
الکترونهای به اشتراک گذاشته شده در یک پیوند کووالانسی
الکترونهای دریای الکترون یک فلز
الکترونهای اشتراکی در یک پیوند داتیو
گزینه سوم درست است. در پیوند یونی الکترون از کاتیون به آنیون منتقل میشود. پس الکترون متعلق به آنیون است. در پیوند کووالانسی الکترونهای اشتراکی متعلق به هر دو هستهای است که الکترون به اشتراک گذاشتهاند.
حتی در پیوندهای قطبی هم این تعلق وجود دارد، اما با نسبت کمتر برای یک هسته و بیشتر برای هسته دیگر. در پیوند داتیو الکترونها به اتمی که آنها را دریافت میکند، متعلقاند. فقط در پیوند فلزی است الکترونهای خارج شده از هر اتم بهصورت یک دریای الکترون بین هستههای با بار مثبت در حال حرکتاند و به هیچ اتم خاصی تعلق ندارند.
برای تشکیل پیوند هیدروژنی بین دو مولکول چه شرایطی لازم است؟
یک مولکول دارای اتم هیدروژن و یک مولکول دارای جفت الکترون تنها باشد.
یک مولکول دارای اتم هیدروژن و یک مولکول دارای یک الکترون تنها باشد.
یک مولکول دارای اتمی با الکترونگاتیوی بالا و یک مولکول دارای جفت الکترون تنها باشد.
گزینه اول درست است. گفتیم برای اینکه پیوند هیدروژنی بین دو مولکول برقرار شود، باید یک پیوند کووالانسی قطبی در یک مولکول دارای اتم هیدروژن برقرار شده باشد، طوری که سر هیدروژندار این مولکول دارای بار مثبت جزئی باشد.
به این ترتیب، این مولکول اگر کنار مولکولی که جفت الکترون تنها دارد قرار بگیرد، بین بار جزئی مثبت روی اتم هیدروژن و جفت الکترون تنها جاذبه پیوند هیدروژنی ایجاد میشود.
پیوند بین اتمهای Cl و Cs بهعنوان یک فلز و نافلز از کدام نوع است؟
کووالانسی غیرقطبی
کووالانسی قطبی
گزینه سوم درست است. حتی اگر با عناصر سزیم و کلر آشنایی نمیداشتیم، چون در سوال اشاره به پیوند بین فلز و نافلز شده است، بنابراین پیوند یونی خواهد بود.
در کدام ساختار ذرات تشکیلدهنده مجموعهای از یونهای مثبت و منفی است؟
ساختار کووالانسی
گزینه اول درست است. در یک ساختار یونی که بر اساس پیوندهای یونی ساخته شده است، بر اثر انتقال الکترونها و تشکیل کاتیون و آنیون، کل ساختار متشکل از یونهایی با بار مثبت و منفی است.
در یک پیوند یونی، یونهای با بار مخالف چگونه کنار هم نگه داشته شدهاند؟
نیروی جاذبه مغناطیسی
نیروی جاذبه الکتروستاتیکی
پیوند کووالانسی
گزینه دوم صحیح است. در پیوند یونی پس از انتقال الکترون از یک اتم یه اتم دیگر، اتمها به یونهای مثبت و منفی تبدیل میشوند. پس بین آنها نیروی جاذبه الکتروستاتیک قوی بهعنوان پیوند یونی برقرار خواهد شد.
کدام گزینه در مورد پیوند کووالانسی نادرست است؟
پیوند کووالانسی بین اتمهای نافلز ایجاد میشود.
پیوند کووالانسی از پیوند فلزی ضعیفتر است.
پیوند کووالانسی در نتیجه اشتراک الکترون بین دو هسته ایجاد میشود.
در پیوند کووالانسی همیشه جفت الکترون مشترک به هسته یک اتم نزدیکتر هستند.
گزینه آخر اشتباه است. در پیوند کووالانسی الکترونهای به اشتراک گذاشته شده میتوانند بهصورت برابر با نابرابر بین دو هسته اتم توزیع شوند.
پیوند بین مولکولهای آب و هیدروژن کلرید از کدام نوع است؟
پیوند هیدروژنی – نیروی پراکندگی لاندن
پیوند هیدروژنی – برهمکنش دوقطبی – دوقطبی
برهمکنش دوقطبی – دوقطبی – نیروی پراکندگی لاندن
نیروی پراکندگی لاندن – پیوند هیدروژنی
گزینه دوم درست است. میدانیم پیوند بین مولکولهای آب هیدروژنی است. برای مولکولهای HCl نیز همانطور که در بخش برهمکنش دوقطبی – دوقطبی توضیح دادیم، نیروی بینمولکولی از نوع دوقطبی – دوقطبی است.
source
