همه چیز در جهان از کوچکترین موجودات زنده مانند یک مورچه تا پدیده عظیمی مانند کهکشان، از «ماده» (Matter) ساخته شده است. یک ماده دارای دو مشخصه جرم و حجم است. یعنی هر چیزی که دارای جرم و حجم باشد، ماده محسوب میشود. جرم ماده، مقدار ماده تشکیلدهنده آن است و حجم فضایی است که ماده اشغال میکند. در این مطلب از مجله فرادرس ابتدا به زبان ساده توضیح میدهیم که ماده چیست، کوچکترین جز سازنده ماده چه نام دارد و انواع مواد از نظر اجزای تشکیلدهنده خود، چگونه هستند.
سپس به بیان خواص فیزیکی و شیمیایی مواد، سه حالت ماده و ویژگیهای هر حالت و نحوه تغییر حالت مواد خواهیم پرداخت. در انتهای مطلب، پیشنهاد میکنیم جهت تکمیل یادگیری خود حتما به سوالات آزمون تهیه شده پاسخ دهید.
ماده چیست؟
هر چیزی که فضا اشغال میکند و جرم دارد، ماده است. ماده معمولا در یکی از سه حالت جامد، مایع یا گاز قرار میگیرد. بین حالتهای مختلف ماده، تنها جامدات هستند که دارای شکل و حجم مشخصیاند، در حالی که مایعات و گازها شکل ظرفی که در آن قرار دارند را به خود میگیرند. حالت ماده، یک خاصیت فیزیکی ماده محسوب میشود. مواد علاوهبر خواص فیزیکی، دارای خواص شیمیایی نیز هستند. بر اساس اجزای سازنده، مواد به سه گروه عنصر، ترکیب و مخلوط تقسیم میشوند.
اگر قصد دارید یادگیری خود را از پایه با مبحث اتمها، الفبای مواد شروع کنید، میتوانید فیلم آموزشی علوم تجربی پایه هفتم فرادرس را مشاهده کنید که لینک آن در ادامه قرار داده شده است.
طبق تعریف بالا، لزومی ندارد که ماده قابل دیدن باشد. یعنی اگر چیزی فضایی اشغال کرد و جرم داشت، اما با قویترین میکروسکوپها هم قابل دیدن نبود، باز هم ماده محسوب میشود. اگر طبقهبندی مواد را بر اساس حالت آنها انجام دهیم، مواد در سه گروه جامد، مایع و گاز قرار میگیرند.

برای مثال آب مادهای است که هر سه حالت را در دماهای مختلف میتواند نشان دهد. در دماهای پایین (دمای زیر ۰ °C)، آب در حالت جامد است. در دماهای نرمال مانند دمای اتاق (بازه دمایی بین ۰ °C تا ۱۰۰ °C)، آب مایع است و در دماهای بالاتر از ۱۰۰ °C، آب در حالت گازی است. حالت جامد آب، یخ و حالت گازی آن، بخار آب نام دارد. بنابراین حالتی که آب نشان میدهد، کاملا به دما وابسته است.
چه چیزهایی ماده نیستند؟
جهان از دو بخش مهم به نام ماده و انرژی تشکیل شده است. انواع انرژی شامل صدا، نور و جاذبه، یا مفاهیمی مانند رویاها و احساسات، زمان، رنگینکمان و ریزموجها، ماده محسوب نمیشوند. بهجز مواردی که به آنها اشاره شد، تمام مثالهای این مطلب، ماده هستند.

در ادامه ابتدا با کوچکترین بخش سازنده ماده آشنا میشویم. سپس با توجه به اجزای تشکیلدهنده آن، تفاوتهای دو گروه مهم از مواد یعنی «مواد مخلوط یا ناخالص» (Mixture Substance) و «مواد خالص» (Pure Substance) را توضیح میدهیم.
| ماده | |||
| مخلوط | ماده خالص | ||
| مخلوط ناهمگن | مخلوط همگن | ترکیب | عنصر |
 |
|||
اتم چیست؟
اتم کوچکترین جز یک ماده است. مواد میتوانند از یک نوع اتم یا چند نوع اتم ساخته شوند. مادهای که فقط از یک نوع اتم ساخته شود، «عنصر» (Element) نام دارد. در واقع این اتم است که منشا تمام ویژگیهای شیمیایی یک عنصر محسوب میشود. اتمها معمولا در ساختارهای بزرگتری به نام مولکولها قرار میگیرند. یک مولکول گروهی از دو یا چند اتم است که توسط پیوندهایی به یکدیگر چسبیدهاند. در شکل زیر یک قطره آب بهعنوان یک ماده نشان داده شده است که متشکل است از تعداد زیادی از مولکولهای آب. از طرفی، هر مولکول آب نیز از پیوند اتمهای هیدروژن و اکسیژن ساخته شده است و ساختار هر کدام از این اتمها، شامل ذرات زیراتمی است.
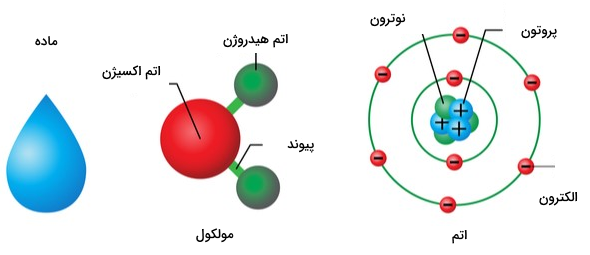
ساختار اتم متشکل از دو ناحیه است. اولین ناحیه، هسته کوچکی است در مرکز اتم که شامل ذراتی با بار الکتریکی مثبت به نام پروتون و ذراتی بدون بار به نام نوترون است. طبق مدل کوانتومی اتم، ناحیه بزرگتر دور هسته ابر الکترونی است که از الکترونهای با بار منفی تشکیل شده است. جاذبه بین الکترونهای منفی و هسته با بار مثبت، باعث میشود اتمها کنار هم قرار بگیرند. اگر بخواهیم ساختار ماده را جزئیتر از این بررسی کنیم، پروتونها و نوترونهای هسته از ترکیب ذرات بنیادی به نام «کوارکها» (Quark) ساخته شدهاند.
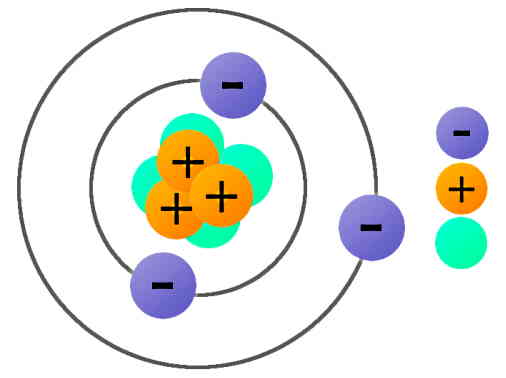
بیشتر اتمها هر سه ذره زیراتمی یعنی الکترون، پروتون و نوترون را دارند اما برای مثال اتم هیدروژن یک استثنا است. هیدروژن دارای یک الکترون و یک پروتون است و نوترونی ندارد. تعداد پروتونهای هسته اتم تعیین میکند که این اتم برای کدام عنصر است، در حالی که تعداد الکترونهای دور هسته مشخص میکند که این اتم چه نوع واکنشهایی را میتواند تحمل کند.
یادگیری ماده با فرادرس برای دانشآموزان
اگر دانشآموز هستید، احتمالا در پایههای مختلف و بهصورت پراکنده در کتابهای علوم تجربی، فیزیک یا شیمی بخشهایی از مباحث مربوط به ماده را فرا گرفتهاید. در لیست زیر، بخشی از آموزشهای مرتبط با مبحث ماده بهترتیب برای شما قرار داده شده است تا بتوانید راهنمای جامعی از تمام کتابهای درسی در این زمینه در اختیار داشته باشید. تماشای این فیلمهای آموزشی تهیه شده در فرادرس، به شما در یادگیری و درک گستردهتر این مبحث کمک زیادی خواهد کرد:
- فیلم آموزش علوم تجربی پایه هفتم فرادرس
- فیلم آموزش علوم تجربی هشتم بخش شیمی فرادرس
- فیلم آموزش علوم تجربی نهم بخش شیمی فرادرس
- فیلم آموزش فیزیک دهم فرادرس
- فیلم آموزش فیزیک دهم مرور و حل تمرین فرادرس
- فیلم آموزش شیمی دهم فرادرس
- فیلم آموزش شیمی دهم حل سوالات امتحانات نهایی فرادرس
- فیلم آموزش شیمی دوازدهم فرادرس
- فیلم آموزش شیمی دبیرستان نکته و حل تست کنکور فرادرس
ماده خالص چیست؟
تا اینجا یاد گرفتیم که ماده چیست و گفتیم میتوانیم بر اساس اجزای تشکیلدهنده، مواد را به دو گروه مواد مخلوط و خالص طبقهبندی کنیم. مواد خالص شامل هر مادهای میشوند که ترکیب ثابتی دارد و خواص مشابهی را در شرایط مشابه نشان میدهد. برای مثال دمای جوش در یک نقطه از ماده خالص با دمای جوش نقطه دیگر آن، برابر است. این مواد، در دو گروه «ترکیب» (Compound) و عنصر تقسیمبندی میشوند.
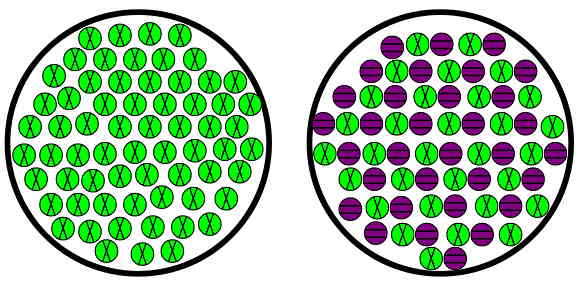
همانطور که در شکل بالا مشخص است، عناصر و ترکیبات موادی هستند که در نوع اتمهایی که در داخل خود دارند، با هم متفاوتاند. عنصر از یک نوع اتم (اتمهای سبز در شکل) ساخته شده است، در حالی که در یک ترکیب ممکن است دو یا چند نوع اتم (در شکل دو نوع اتم سبز و بنفش) وجود داشته باشد. در جدول زیر، مثالهایی از مواد خالص شامل ترکیب یا عنصر آورده شدهاند:
| ماده خالص – ترکیب | ماده خالص – عنصر |
| آب (H2O) | آلومینیم (Al) |
| نمک طعام (NaCl) | آهن (Fe) |
عنصر چیست؟
عناصر مواد خالصی هستند که قابل تجزیه به شکل سادهتر و کوچکتری از ماده نخواهند بود. در واقع این عناصر هستند که سایر انواع ماده را که در بخشهای بعد خواهیم گفت، میسازند. همانطور که در بخش «اتم چیست» بیان کردیم، در یک عنصر، ماده فقط از یک نوع اتم ساخته شده است.

عناصر با هیچ روش شیمیایی یا فیزیکی، قابل جداسازی به مادهای کوچکتر از خودشان نیستند. هر عنصر دارای خواص و ویژگیهای فیزیکی و شیمیایی خاصی است. برای مثال طلا یا کربن عنصر محسوب میشوند. تاکنون ۱۱۸ عنصر کشف شده است که ۹۲ عدد از این عناصر، بهطور طبیعی وجود دارند. مابقی عناصر ناپایداری هستند که در آزمایشگاه توسط عناصر طبیعی ساخته میشوند.
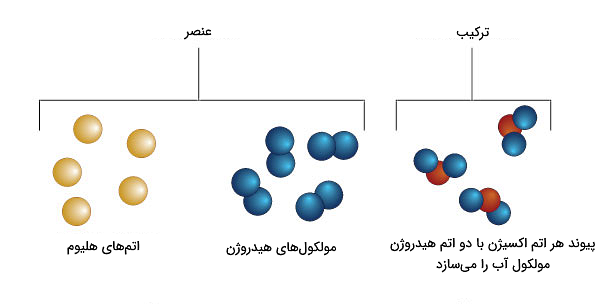
شکل بالا تفاوت عنصر و ترکیب را بهتر نشان میدهد. مجموعهای از مولکولهای هیدروژن که متشکل از یک نوع اتم هستند، عنصر محسوب میشوند. اما برای مثال یک قطره آب مجموعهای است از مولکولهای آب که در هر مولکول دو نوع اتم وجود دارد، اکسیژن و هیدروژن. پس آب یک ترکیب است نه عنصر.
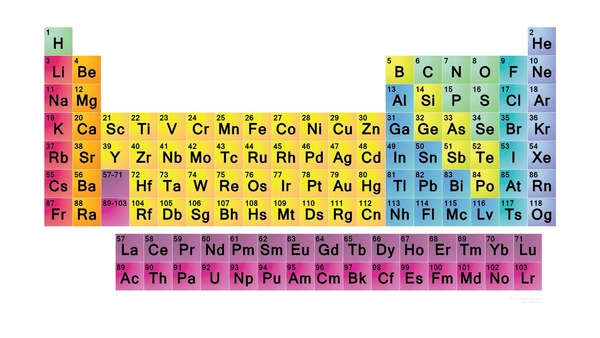
جدول تناوبی عناصر
با پیشرفت علم و کشف عناصر جدید، دانشمندان تصمیم گرفتند تمام اطلاعاتی که در مورد عناصر مختلف بهدست آمده است را بر اساس قواعد خاصی در قالب یک جدول جمعآوری و تنطیم کنند. این جدول، جدول تناوبی عناصر نامیده شد. جدول تناوبی اطلاعاتی مانند جرم، بار یونی و ذراتی که در هسته اتمهای عناصر قرار دارند را نشان میدهد.
هر عنصر در جدول تناوبی، توسط نماد شیمیاییاش نشان داده میشود که معمولا یک حرف لاتین بزرگ یا ترکیبی از دو یا چند حرف لاتین است. برای مثال عنصر کربن با C، عنصر کلسیم با Ca و عنصر سدیم با Na نشان داده میشوند. چهار عنصری که در تمام ارگانهای زنده وجود دارند عبارتاند از اکسیژن (O)، کربن (C)، هیدروژن (H) و نیتروژن (N). این چهار عنصر روی هم رفته حدود ۹۶٪ از بدن انسان را تشکیل میدهند.
ترکیب چیست؟
یک ترکیب ماده خالصی است که شامل دو یا چند عنصر است، به گونهای که این عناصر با هم پیوند شیمیایی دارند و دارای خواص ثابتی هم هستند. ترکیبات زمانی قابلیت جداسازی به عناصر تشکیلدهنده خود را دارند که از روشهای شیمیایی خاصی برای این منظور استفاده شود. یک نمونه از این روشهای شیمیایی که برای جداسازی عناصر تشکیلدهنده برخی ترکیبات استفاده میشود، «الکترولیز» (Electrolysis) است.
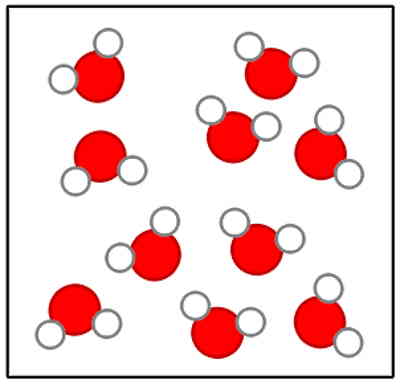
برای مثال، آب یک نمونه ماده خالص است که یک ترکیب محسوب میشود. آب ترکیبی از دو عنصر هیدروژن و اکسیژن است و دارای خواص ثابتی است. همچنین میتوانیم با عبور جریان الکتریکی و شکستن پیوندهای شیمیایی، آب را به دو عنصر تشکیلدهندهاش تجزیه کنیم.

خواص شیمیایی و فیزیکی یک ترکیب، کاملا با خواص شیمیایی و فیزیکی عناصر تشکیلدهندهاش متفاوت است. برای مثال نمک مصرفی (NaCl) یک ماده خالص ترکیب و جامد سفید رنگی است که از دو عنصر سدیم (Na) و کلر (Cl) تشکیل شده است. در حالی که عنصر سدیم به تنهایی نقرهای رنگ است و به شدت با آب واکنش میدهد و عنصر کلر یک گاز سبز رنگ و سمی است. به فرآیندی که در آن عناصر با هم ترکیب میشوند تا ترکیب جدید ساخته شود، واکنش شیمیایی گفته میشود. شکل زیر ترکیب دو عنصر آهن (Iron) و سولفور یا گوگرد (Sulfur) را نشان میدهد که یک ماده ترکیب به نام «سولفید آهن» (Iron sulfide) را تولید میکنند.
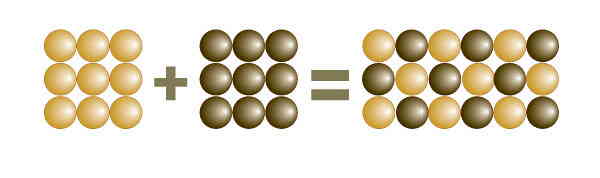
ماده مخلوط چیست؟
مواد مخلوط در طبیعت فراواناند. هوا یک نمونه ماده مخلوط است. این مواد ترکیبی از دو یا چند ماده خالص هستند به گونهای که هیچ پیوند شیمیایی بین آنها وجود ندارد. بنابراین اجزای چنین موادی با کمک گرفتن از روشهای فیزیکی مثل فیلتر کردن یا بلورسازی، قابل جداسازی هستند. در حالی که ترکیب مواد مخلوط میتواند تغییر کند و در نتیجه خواص آنها هم میتواند عوض شود، اما هر کدام از اجزای این مواد ترکیبات و خواص خود را همواره حفظ میکنند.
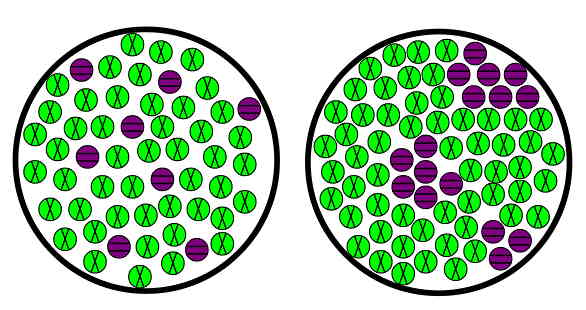
مواد مخلوط به دو گروه مواد مخلوط «همگن» (Homogeneous) و «ناهمگن» (Heterogeneous) تقسیم میشوند که در ادامه این بخش، توضیح این دو گروه بیان شده است. اگر طبق شکل بالا به نحوه پراکندگی اتمها در مواد همگن و ناهمگن دقت کنید، متوجه خواهید شد که در مواد همگن اتمهای بنفش پراکندگی بیشتری دارند، اما در مواد ناهمگن اتمهای بنفش در نواحی خاصی جمع شدهاند.
اگر این تصویر را با تصویر ابتدای بخش «ماده خالص چیست» مقایسه کنید، واضح است که نحوه قرارگیری اتمهای سبز و بنفش در یک ترکیب با این دو نوع ماده کاملا متفاوت است. در جدول زیر مثالهایی از انواع مواد مخلوط نمایش داده شده است:
| ماده مخلوط ناهمگن | ماده مخلوط همگن |
| سوپ سبزیجات | محلول آبنمک |
| مخلوط آب و نفت | فولاد |
| خاک | آبپرتغال |
مخلوط همگن چیست؟
مواد مخلوط همگن ترکیب یکنواختی دارند و در نتیجه در سراسر یک ماده خالص همگن، خواص یکسانی دیده میشود. یک ماده زمانی مخلوط همگن محسوب میشود که تمام اجزای آن در حالت فیزیکی مشابهی قرار داشته باشند. بخار دودکش یک نمونه مخلوط همگن متشکل از گازهای مختلف است. همچنین آلیاژهای فلزی نیز نمونهای از مخلوط همگن شامل اجزای مختلفی در حالت جامد است. شکر حل شده در آب نیز یک مخلوط همگن محسوب میشود. همچنین تمام «محلولها» (Solution) هم به نوعی مخلوط همگن هستند.
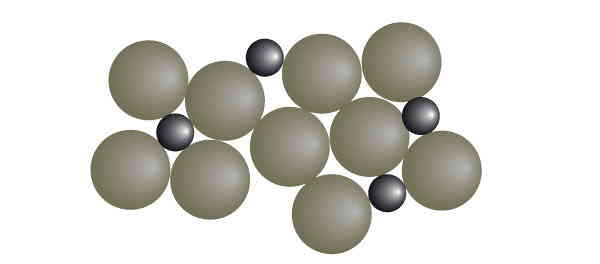
مخلوط ناهمگن چیست؟
مواد مخلوط ناهمگن دارای ترکیب غیریکنواختیاند و در نتیجه خواص مختلفی در نقاط مختلف این مواد دیده میشود. اجزای تشکیلدهنده آنها میتوانند یک یا چند حالت فیزیکی داشته باشند. برای مثال مخلوط ماسه و آب، یک مخلوط ناهمگن است که دارای دو حالت فیزیکی مختلف جامد و مایع است. انواع کلوئیدها، امولسیونها و سوسپانسیونها در گروه مواد مخلوط ناهمگن قرار میگیرند.
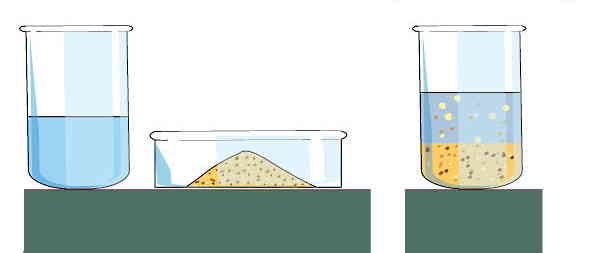
ویژگیهای ماده چیست؟
پس از اینکه آموختیم ماده چیست و از چه اجزایی تشکیل شده است، در این بخش قصد داریم با انواع خصوصیات یا ویژگیهای ماده آشنا شویم. تمام مواد دارای خواص فیزیکی و شیمیایی هستند. اما هیچ دو مادهای در شرایط یکسان دارای خواص فیزیکی و شیمیایی کاملا مشابهی نیستند. همین نکته باعث میشود که از خواص فیزیکی و شیمیایی مواد جهت شناسایی آنها بتوانیم استفاده کنیم.

یک ماده خالص همیشه خواص فیزیکی و شیمیایی یکسانی دارد. برای مثال، آب بهعنوان یک ترکیب خالص تنها مایع بیرنگ و شفافی است که در فشار استاندارد، چگالی ۱ gr/mL دارد و در دمای ۱۰۰ °C میجوشد. همچنین، مس (Cu) بهعنوان یک عنصر خالص، همیشه یک جامد قرمز مایل به قهوهای است (خاصیت فیزیکی) و با حل شدن در اسید نیتریک رقیق شده، یک محلول آبی رنگ و یک گاز قهوهای تولید میکند (خاصیت شیمیایی).
در جدول زیر به چند نمونه از خواص شیمیایی و فیزیکی برای مواد مختلف اشاره شده است:
| خواص شیمیایی | خواص فیزیکی |
| خوردگی فلز آهن | ذوب شدن عنصر فلزی گالیم (Ga) در دمای ۳۰ °C |
| پوسیدگی موز و تغییر رنگاش | چگال بودن جیوه مایع |
| سوختن یک تکه کاغذ خشک | درخشندگی زیاد طلا |
خواص فیزیکی ماده چیست؟
آن خواصی از ماده که برای توصیف ماده بکار میروند و بدون تغییرات در ترکیب شیمیایی ماده قابل اندازهگیری و مشاهدهاند، خواص فیزیکی ماده نام دارند. خواص فیزیکی ماده شامل رنگ، سختی، جرم، حجم، چگالی، نقطه ذوب، نقطه جوش، رسانایی الکتریکی و میزان حلالیت میشوند. نکته مهم در مورد خواص فیزیکی این است که شاید در این خواص ظاهر ماده تغییر کند، ولی ترکیب شیمیایی ماده عوض نمیشود.

برای مثال یک قطعه یخ، ترکیب شیمیایی از اکسیژن و هیدروژٰن است که در حالت جامد قرار دارند. اگر یخ ذوب شود، حالت فیزیکی آن به مایع تغییر میکند. اما ترکیب شیمیایی آن که همچنان شامل اکسیژن و هیدروژن است، عوض نمیشود. اگر بخواهیم چند مورد از خواص فیزیکی مادهای مثل آب را نام ببریم، میتوانیم به بیرنگ بودن، دمای جوش ۱۰۰ °C، دمای انجماد ۰ °C و چگالی ۱ gr/mL اشاره کنیم.
در مورد عناصر، استفاده از خاصیت فیزیکی مثل رنگ چندان برای تشخیص و شناسایی آنها از هم سودمند نیست. اما چگالی میتواند گزینه خوبی برای این هدف باشد. خاصیت فیزیکی دیگری که در مورد کاربرد عناصر مهم است، سختی است. برخی عناصر مانند طلا یا نقره سختی کمی دارند در حالی که عناصری مثل تیتانیوم (Ti) و تنگستن (W) سختی بالایی دارند. در مورد خاصیت سختی، کربن عنصر جالبی است. کربن اگر به شکل گرافیت باشد، خیلی نرم است اما در شکل الماسی خود، حدودا هفت برابر سختتر میشود.
نقطه ذوب و نقطه جوش نیز از جمله خواص مهمی هستند که بهخصوص برای شناسایی ترکیبات از هم کاربرد دارند. علاوهبر این، از این دو خاصیت فیزیکی میتوان اطلاعات خوبی در مورد میزان خلوص ترکیبات نیز بهدست آورد. خواص فیزیکی را میتوانیم در دو گروه قرار دهیم:
- خواص فیزیکی متمرکز: این خواص به مقدار ماده بستگی ندارند. برای مثال نقطه جوش آب همیشه ۱۰۰ °C است و فرقی ندارد نقطه جوش یک لیتر آب را بخواهیم بدانیم یا هزار لیتر آب. یا رنگ ید که همیشه ثابت است، مستقل از اینکه چقدر ید مدنظر باشد.
- خواص فیزیکی گسترده: این خواص به مقدار ماده بستگی دارند. مثلا حجم و جرم هر دو خواصی هستند که به مقدار ماده وابستهاند.
خواص شیمیایی ماده چیست؟
خواص شیمیایی ماده، بر اثر تغییر در ترکیبات ماده حاصل میشوند. این تغییرات که از واکنشهای شیمیایی ناشی شدهاند، منجر به تشکیل یک ماده جدید میشوند. اشتعالپذیری، تجزیه، تخمیر، انفجار، پوسیدگی، میزان اسیدی بودن و حساسیت به خوردگی، معمولا نمونههایی از خواص شیمیایی هستند. از خواص شیمیایی هم میتوانیم برای تشخیص مواد استفاده کنیم. اما در مقایسه با استفاده از خواص فیزیکی، در اینجا ماده بر اثر تغییرات شیمیایی رخ داده شده به ماده دیگری تبدیل خواهد شد و مشاهده خواص شیمیایی فقط در حین چنین فرآیندی امکان پذیر است.

برای مثال زمانی که ترکیب آهن از طریق واکنش با اکسیژن تغییر میکند و به ماده جدیدی به نام زنگ آهن تبدیل میشود (تصویر بالا) یا واکنش منیزیم با اکسیژن که باعث تولید اکسید منیزیم به شکل یک پودر سفید رنگ میشود. چند نمونه از خواص شیمیایی آب عبارتاند از عدم واکنش با طلا، قابلیت واکنش شدید با سدیم فلزی و تشکیل هیدروژن و قابلیت تجزیه الکتریکی به هیدروژن و اکسیژن.
ماده چند حالت دارد؟
یک ماده در یک شرایط مشخص، فقط در یک حالت میتواند قرار داشته باشد. حالتهای ماده شامل سه گروه مایع، جامد و گاز هستند. حالتی که برای هر ماده در هر لحظه از زمان مشاهده میکنیم، به عوامل مختلفی مثل دما و فشاری که ماده در آن قرار دارد، بستگی دارد. در دمای اتاق، اکثر مواد جامد هستند. در حالی که فقط برخی مواد آلی در دمای اتاق مایعاند و تنها تعداد کمی از مواد در این دما در دستهبندی گازها قرار میگیرند.

خلاصهای از ویژگیهای هر حالت ماده در جدول زیر بیان شده است:
| گاز | مایع | جامد | ویژگیهای ماده |
| نامشخص | نامشخص | مشخص | شکل |
| نامشخص | مشخص | مشخص | حجم |
| ضعیف | متوسط | قوی | قدرت نسبی برهمکنشهای بینمولکولی |
| آزادانه و در فواصل دور از هم، حرکت دارند | تا حدی از هم دوراند | نزدیک هم هستند | موقعیت نسبی ذرات |
| دارد | دارد | ندارد | قابلیت جاری شدن |
| دارد | دارد | ندارد | قابلیت فشردهسازی |
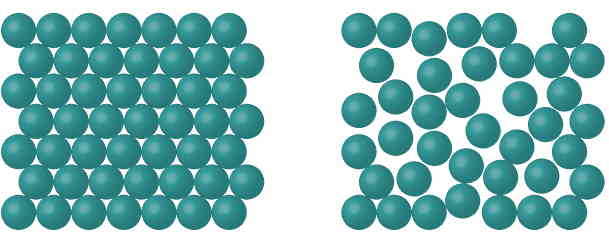
جامد چیست؟
جامد حالتی از ماده است که در آن ذرات تشکیلدهنده ماده بهصورت منظمی در نزدیکی هم قرار گرفتهاند. این چینش منظم در کنار هم باعث میشود که یک جامد ساختاری محکم، با شکل هندسی و حجم مشخص داشته باشد. معمولا یک جامد آنقدر محکم است که قابلیت خیلی کمی برای فشرده شدن یا منبسط شدن دارد. اغلب جامدات سختاند، اما جامدات نسبتا نرمی هم وجود دارد (برای مثال موم یا ژله). در واقع، قدرت پیوندهای بینمولکولی برای جامدات مختلف، متفاوت است. مثلا پیوند بینمولکولهای آهن نسبت به ژله قویتر است. همین مسئله باعث میشود سختی آهن از ژله بیشتر باشد. بیشتر جامداتی که از یونها ساخته شدهاند، شکنندهاند.

در شرایط استاندارد دمای اتاق، بیشتر فلزات مانند آهن و مس جامد هستند. اگر جیوه مایع را تا دمای انجمادش یعنی -۳۹ °C سرد کنیم و در شرایطی که فشار مناسبی هم وجود داشته باشد، جیوه مایع به جامد تبدیل خواهد شد. اما در دمای اتاق، جیوه مجددا به حالت مایع خود بازمیگردد.
اجزای تشکیلدهنده جامدات معمولا در آرایه های سه بعدی و منظمی قرار میگیرند که «بلور» (Crystal) نامیده میشود. این آرایههای منظم گاهی قابل مشاهدهاند. برای مثال کلرید سدیم یا نمک طعام، یک جامد بلوری است. اما در برخی از جامدات، بهخصوص در مورد جامداتی که دارای مولکولهای بزرگ هستند، چنین آرایههای منظمی وجود ندارد. ذرات تشکیلدهنده این جامدات بهجای بلور، یک ساختار «بیشکل یا آمورف» (Amorphous) را میسازند. مثلا شیشه، یک جامد آمورف است.
مایع چیست؟
مایع حالتی از ماده است که در آن ماده حجم مشخص و تعریف شدهای دارد اما شکل هندسیاش مشخص نیست. در واقع اگر مایعات داخل ظرفی ریخته شوند، پس از جاری شدن در ظرف شکل آن ظرف را به خود میگیرند. به همین دلیل است که میگوییم شکل مایعات مشخص نیست. اگر ذرات تشکیلدهنده ماده انرژی کافی برای غلبه بر برهمکنشهای بینمولکولی داشته باشند، میتوانند فاصله بیشتری از هم داشته باشند و در نتیجه اطراف هم آزادنه حرکت کنند یا روی هم سر بخورند. چنین وضعیتی در ماده، حالت مایع نام دارد و باعث میشود ماده شکل مشخصی نداشته باشد.
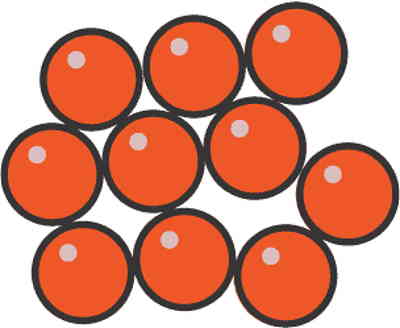
البته در یک مایع همچنان ذرات در تماس نزدیکی با هم قرار دارند، بنابراین مایع دارای حجم مشخصی است. در شرایط استاندارد دمای اتاق، آب، فلز جیوه و برم مایع هستند. فلز جیوه یک استثنا است، از این نظر که تنها فلزی است که در دمای اتاق در حالت مایع وجود دارد. اگر جیوه را تا دمای جوش آن یعنی دمای ۳۷ °C حرارت دهیم، در شرایط فشار مناسب جیوه مایع به حالت گاز تبدیل میشود.

گاز چیست؟
در مقایسه با دو حالت دیگر ماده، حجم و شکل گازها کاملا نامشخص است، چون ذرات تشکیلدهنده آنها در حال حرکتاند. ذرات تشکیلدهنده گازها در مقایسه با جامدات، در فاصله خیلی خیلی دورتری از هم قرار دارند. این خاصیت موجب شده است تا گازها به راحتی فشرده شوند یا آنقدر منبسط شوند که یک ظرف خیلی بزرگتر را بتوانند کاملا پر کنند.

درواقع اگر ذرات تشکیلدهنده ماده آنقدر انرژی داشته باشند که کاملا بر برهمکنشهای بین مولکولی غلبه کنند، آنگاه این ذرات قادراند از هم جدا شوند و بهصورت تصادفی در فضا حرکت کنند. چنین وضعیتی، توصیفی از حالت گازی است. معمولا تغییر حالت ماده از جامد به مایع، چندان روی حجم ماده تغییری ایجاد نمیکند. ولی تغییر حالت از مایع به گاز، با افزایش حجم قابلتوجه ماده (۱۰۰۰ برابر یا بیشتر) همراه است.
برای اکثر موادی که در اطراف خود مشاهده میکنیم نشان دادن اینکه دارای جرم و حجم هستند تقریبا آسان است. اما در مورد برخی مواد مانند هوا، نشان دادن این دو خصوصیت ماده چندان آسان نیست. هوا یا عموم گازها قابل مشاهده با چشم انسان نیستند. معمولا جرم خیلی کوچکی در مقایسه با جامدات و مایعات دارند. همچنین همانطور که گفتیم گازها به آسانی قابلیت تغییر حجم دارند. این ویژگیها باعث میشود تا به راحتی متقاعد نشویم که گازها مثلا هوا هم ماده محسوب میشوند. در شرایط استاندارد دمای اتاق، اکسیژن، دیاکسیدکربن، آمونیاک و متان گاز هستند.

پلاسما، حالت چهارم ماده
اگر بخواهیم تقسیمبندی حالتهای ماده را دقیقتر و بهروزتر بیان کنیم، در واقع دو حالت دیگر میتوانیم برای مواد در نظر بگیریم. «پلاسما» (Plasma) بهعنوان حالت چهارم ماده و «چگالش یا میعانات بوز-انیشتین» (Bose-Einstein Condensate) بهعنوان حالت پنجم. در بخشهای بعد خواهیم دید وقتی که مایعی حرارت داده شود، به علت افزایش انرژی ذرات تشکیلدهندهاش، به حالت گاز تبدیل میشود. با همین استدلال، اگر گازی را داغ کنیم، به پلاسما تبدیل میشود.
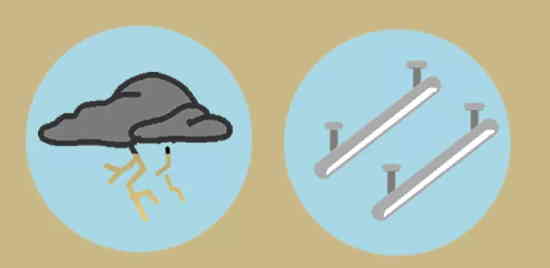
پلاسما مخلوطی از ذرات باردار با بار مثبت (یونها) و ذرات باردار با بار منفی (الکترونها) است، در نتیجه یک گاز یونیده شده محسوب میشود که رسانایی الکتریکی خیلی خوبی دارد. رعدوبرق مثال معمولی از تشکیل پلاسما است. همچنین، ستارهها در حالت پلاسما قرار دارند. مطالعه مطلب «پلاسما در فیزیک — به زبان ساده» از مجله فرادرس، به شما اطلاعات کاملی در مورد حالت چهارم ماده خواهد داد. حالت پنجم ماده زمانی تشکیل میشود که یک گاز بوزونی با چگالی خیلی پایین، تا دمای نزدیک به صفر مطلق سرد شود. فراهم کردن چنین شرایطی، اصلا آسان نیست و در این مطلب نیز به توضیح بیشتر آن نمیپردازیم.
تغییرات در ماده
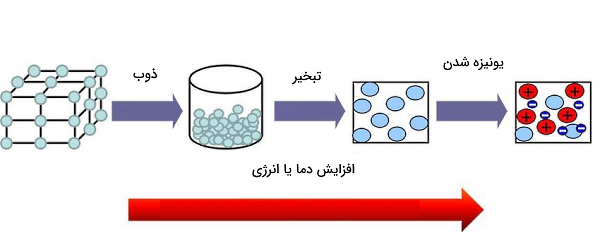
پس از اینکه یاد گرفتیم ماده چیست و چه حالتهایی دارد، در این بخش و بخش بعدی به بررسی انواع تغییر حالتهای ماده میپردازیم. تغییرات در ماده شامل دگرگونیهایی است که ماده را از شکلی به شکل دیگر تبدیل میکند. این تغییرات میتوانند تغییر فیزیکی یا شیمیایی باشند. در شکل زیر مشاهده میکنید که با افزایش دما، جامد به مایع تبدیل شده است (یک تغییر فیزیکی به نام ذوب). سپس با بیشتر کردن دما، مایع به گاز (تغییر فیزیکی دیگری به نام تبخیر) تبدیل میشود. در ادامه انواع تغییرات در ماده را با هم بررسی میکنیم تا بتوانیم دانش خود را در پاسخ به پرسش ماده چیست، تکمیل کنیم.
تغییر شیمیایی در ماده
منظور از تغییر شیمیایی، همان تغییر در ترکیب شیمیایی ماده است. در این تغییر ماده اولیه برای تشکیل ماده جدیدی استفاده میشود. ماده جدید ساخته شده، از نظر خواص فیزیکی و شیمیایی با ماده اولیهای که استفاده شده است کاملا فرق دارد. معمولا مواد خواص شیمیایی خود را زمانی که در معرض یک تغییر شیمیایی قرار بگیرند، نشان میدهند. یک مثال خوب برای تغییر شیمیایی، سوختن شمع است.
زمانی که یک تغییر شیمیایی رخ میدهد، امکان مشاهده اینکه آیا پیوندها شکسته شدهاند یا پیوند جدیدی تشکیل شده است، وجود ندارد. اما یکی از نشانههایی که میتوانیم بهعنوان احتمال رخ دادن یک تغییر شیمیایی در نظر بگیریم، تغییرات انرژی است. نشانههای دیگری مانند تغییرات دمایی، تابش نور، تغییرات رنگی غیرقابل انتظار، تشکیل حباب در برخی موارد بدون اینکه ماده به دمای جوش رسیده باشد و احساس بو یا طعم متفاوت، همه میتوانند نشاندهنده رخ دادن یک تغییر شیمیایی باشند.
تغییر فیزیکی در ماده
تغییرات فیزیکی زمانی رخ میدهند که خواص فیزیکی یک ماده بدون تغییری در ترکیبات شیمیایی آن، عوض شوند. در واقع پس از اینکه یک تغییر فیزیکی اتفاق میافتد، ماده جدیدی ساخته نمیشود. بهعنوان مرسومترین تغییرات فیزیکی، میتوانیم به تغییرات آب از حالت مایع به حالت گاز یا جامد اشاره کنیم که طی آن مولکولهای آب تغییری نمیکنند. در یک تغییر فیزیکی، پیوندی شکسته یا ایجاد نمیشود. در این تغییر تنها نحوه حرکت مولکولها عوض میشود.
شش تغییر فیزیکی مرسوم شامل «ذوب» (Melting)، «انجماد» (Freezing)، «تبخیر» (Vaporization)، «میعان» (Condensation)، «تصعید» (Sublimation) و «چگالش» (Deposition) هستند. در واقع این شش تغییر فیزیکی، همان تغییر حالتهای ماده محسوب میشوند. البته تغییرات فیزیکیای وجود دارند که لزوما شامل تغییر حالت ماده نمیشوند. برای مثال انواع تغییر شکل فیزیکی مواد (برش، فرورفتگی یا کشش)، جداسازی یک مخلوط یا ساخت محلولهای خاص، نمونههایی از تغییرات فیزیکی بهشمار میروند.
انواع تغییرات فیزیکی در دو گروه «برگشتپذیر» (Reversible) و «برگشتناپذیر» (Irreversible) قرار داده شدهاند. یخ ذوب شده قابلیت این را دارد که مجددا منجمد شود. پس ذوب، یک تغییر فیزیکی برگشتپذیر است. در واقع تمام تغییر حالتهای ماده، تغییرات فیزیکی برگشتپذیراند.
انواع تغییر حالت ماده
تغییر حالت در ماده زمانی اتفاق میافتد که ماده انرژی از دست بدهد یا انرژی جذب کند. اگر ماده انرژی جذب کند، مولکولها و اتمهای آن سریعتر حرکت خواهند کرد. در نتیجه، انرژی جنبشی ذرات تشکیلدهنده آن طوری زیاد میشود که ماده میتواند حالت خود را عوض کند. این انرژی معمولا گرما است. در کنار دما، فشار هم عامل دیگری است که میتواند روی تغییر حالت ماده اثرگذار باشد. اگر انرژی کافی برای تغییر حالت تامین شود، برای هر مادهای در جهان امکان تغییر حالت وجود دارد.
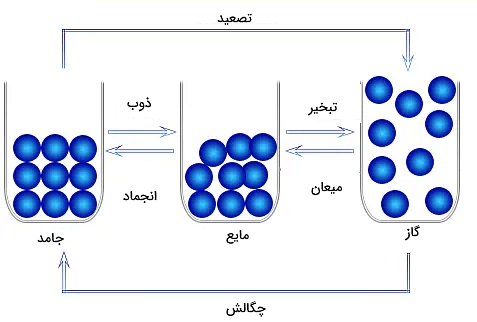
نکته: دمایی که در آن یک تغییر حالت برای ماده رخ میدهد، برای مواد مختلف متفاوت است، چون قدرت پیوندهای بینمولکولی مواد با هم فرق دارد. همچنین این دما میتواند به فشار هم بستگی داشته باشد.
با در نظر گرفتن سه حالت جامد، مایع و گاز برای ماده و با انجام یک محاسبه ساده ریاضی، انتظار داریم شش تغییر حالت ممکن در طبیعت وجود داشته باشد. در این بخش میخواهیم این تغییر حالتهای مختلف را توضیح دهیم.
انجماد
انجماد، تعییر حالت ماده از مایع به جامد است. اگر بخواهیم آب یخ بزند، آن را در محیطی با دمای پایین مانند فریزر قرار میدهیم. به این ترتیب، آب که دمای بالاتری از هوای داخل فریزر دارد، گرمای خود را به فریزر میدهد و با از دست دادن حرارت، سرد میشود. این انتقال حرارت آنقدر ادامه دارد تا زمانی که دیگر ذرات تشکیلدهنده آب نتوانند حرکت کنند. طبق تعریفی که در بخشهای قبل برای حالت مایع و جامد داشتیم، میتوانیم بگوییم با ثابت شدن تقریبی ذرات در جای خود، حالت ماده از مایع به جامد عوض شده است. چنین فرآیندی انجماد نام دارد و دمایی که در آن مایع به جامد تبدیل میشود، دمای انجماد یا نقطه انجماد نامیده میشود.
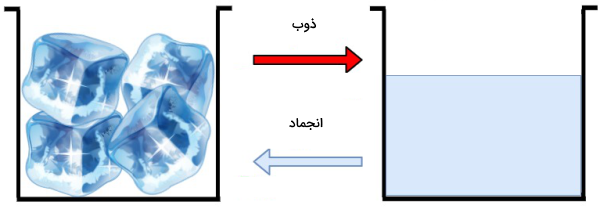
ذوب
ذوب، تغییر حالت ماده از جامد به مایع است. در واقع انجماد و ذوب دو تغییر حالتی هستند که عکس یکدیگر عمل میکنند. در شکل بالا مشاهده میکنید که این دو تغییر حالت عکس هم عمل میکنند. در ذوب ماده انرژی یا گرما دریافت میکند، در حالی که در انجماد، ماده انرژی یا دما از دست میدهد.

فرض کنید یخهای مرحله قبل را از فریزر خارج میکنیم. در محیط اتاق ذرات تشکیلدهنده یخ با جذب انرژی گرمایی از محیط اطراف بر نیروهایی که باعث محکم نگه داشتن آنها سرجای خود شده است، غلبه میکنند. به این ترتیب ذرات از هم فاصله گرفته و با جذب انرژی گرمایی قادراند در فواصل دورتری از هم به اطراف حرکت کنند. بنابراین یخ به آب تبدیل شده است. چنین فرآیندی را ذوب مینامیم و دمایی که در آن تبدیل حالت جامد به مایع اتفاق میافتد، دمای ذوب یا نقطه ذوب نام دارد.
تبخیر
تبخیر، تغییر حالت ماده از مایع به گاز است. فرض کنید مقداری آب را روی حرارت قرار میدهید. حرارتی که از طریق اجاق گاز توسط مولکولهای آب جذب میشود باعث خواهد شد انرژی جنبشی آنها زیاد شود. در نتیجه ذرات تشکیلدهنده آب در فواصل خیلی دورتری از هم قرار میگیرند و بهصورت تصادفی در تمام محیط ظرف پراکنده خواهند شد.
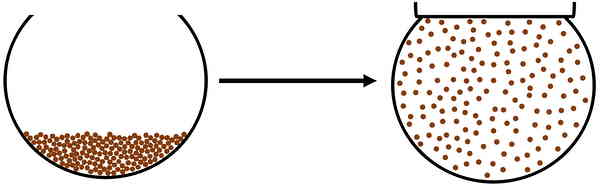
پس آب به بخار یا حالت گازی تبدیل شده است و به اصطلاح میگوییم آب به جوش آمده است. نشانه آب در حال جوشیدن، حبابهای آبی است که روی سطح آب در ظرف ایجاد میشوند و با باز شدن درب ظرف، وارد محیط اطراف نیز خواهند شد. چنین فرآیندی تبخیر نام دارد. دمایی که در آن مایع به گاز تبدیل میشود یا دمایی که در آن مایع میجوشد، دمای جوش یا نقطه جوش نامیده میشود.
میعان
میعان، تغییر حالت ماده از گاز به مایع است. در واقع تبخیر و میعان دو تغییر حالتی هستند که عکس یکدیگر عمل میکنند. اگر یک دوش کاملا داغ در یک حمام در بسته را در نظر بگیرید، احتمالا مشاهده کردهاید که با بسته بودن درب حمام، در مدت کوتاهی قطرات آب روی آینه حمام تشکیل خواهند شد. در واقع ابتدا ذرات آب روی دوش داغ، تبخیر میشوند. سپس ذرات این بخار تشکیل شده، با آینه برخورد میکنند و چون دمای آینه پایینتر است، پس انرژی گرمایی خود را به آینه میدهند.

در واقع ذرات بخار، انرژی از دست خواهند داد و با کم شدن انرژی جنبشی، حرکت این ذرات در فواصل کوتاهتری نسبت به قبل انجام میشود، طوری که دیگر مانند ذرات یک گاز حرکت نمیکنند. بلکه دیگر تبدیل به مایع شدهاند. بنابراین قطرات آب روی آینه تشکیل میشوند و چنین فرآیندی را میعان مینامیم. معمولا تشکیل قطرات آب روی شیشه بر اثر میعان را شبنم مینامند.
تصعید
تصعید یا فرازش، تغییر حالت ماده از جامد به گاز است. در این نوع تغییر حالت، نکته مهمی که در ابتدا به نظر میرسد وجود داشته باشد این است که در تبدیل جامد به گاز، ماده ابتدا باید از حالت مایع عبور کند. اما واقعیت این است که در مواردی جامدات میتوانند بهطور مستقیم به گاز تبدیل شوند. این فرآیند زمانی رخ میدهد که ذرات تشکیلدهنده جامد آنقدر انرژی دریافت میکنند که میتوانند کاملا بر نیروهای جاذبه بین خود غلبه کنند. در نتیجه رفتاری مانند ذرات یک گاز دارند. یخ خشک (CO2 جامد) نمونهای از یک جامد است که طی فرآیند تصعید مستقیما به گاز تبدیل میشود.
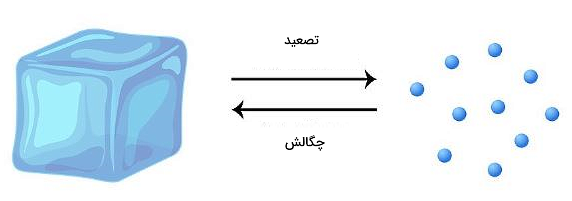
چگالش
چگالش، تغییر حالت ماده از گاز به جامد است. در واقع تصعید و چگالش دو تغییر حالتی هستند که عکس یکدیگر عمل میکنند. همانطور که در مورد تصعید گفتیم، امکان تبدیل مستقیم حالت گاز به حالت جامد نیز در برخی موارد وجود دارد، بدون اینکه نیاز به گذر از حالت میانی به نام حالت مایع وجود داشته باشد. ایجاد برفک در یخچال، نمونهای از فرآیند چگالش است.
تکمیل یادگیری ماده با فرادرس برای دانشجویان
در این مطلب آموختیم که ماده چیست و چه خصوصیاتی دارد. در این بخش لازم است اشاره کنیم که اگرچه تعریف ماده شاید در ابتدا ساده بنظر برسد، اما مباحث مطرح شده در مورد انواع مواد و ویژگیهای آنها در کنار تغییر حالتهای مختلفی که برای مواد اتفاق میافتند، بسیار گسترده است. بهویژه همانطور که گفتیم امروزه از خصوصیات مواد مختلف، جهت شناسایی مواد و آنالیز آنها در علم مواد استفاده میشود. چنانچه تمایل دارید فیلمهای آموزشی پیشرفتهتری در حوزه علم مواد یا شیمی مواد مشاهده کنید، میتوانید از این عناوین فرادرس استفاده کنید:
- فیلم آموزش شیمی عمومی فرادرس
- فیلم آموزش رایگان آشنایی با انواع تغییرات فیزیکی فرادرس
- فیلم آموزش علم مواد فرادرس
- فیلم آموزش آنالیز پیشرفته مواد فرادرس
- فیلم آموزش نانوشیمی فرادرس
آزمون ماده
اگر تمایل دارید میزان یادگیری خود در مورد این مطلب از مجله فرادرس را بیازمایید، میتوانید به سوالات آزمون زیر پاسخ دهید. پس از پاسخدهی، با کلیک روی بخش «دریافت نتیجه آزمون» میتوانید نمره خود را مشاهده کنید.
کدام یک از گزینههای زیر، همگی ماده محسوب میشوند؟
صدای آژیر آمبولانس – هوا
شعلههای آتش – افکار
هر دو مورد در گزینه سوم، ماده هستند. دود و خون هر دو موادی مخلوط محسوب میشوند. فوتون ذرهای بدون جرم است، پس ماده نیست.
صندلی یک ماده جامد و هوا یک ماده مخلوط به حالت گاز است. صدای آژیر نوعی صوت است که ماده نیست. شعلههای آتش از جنس انرژی گرمایی و نور هستند که ماده حساب نمیشوند.
کدام حالت از ماده حجم مشخصی ندارد؟
گزینه آخر صحیح است. همانطور که گفته شد، بین سه حالت از ماده تنها گازها هستند که حجم مشخصی ندارند.
مواد زیر از نظر اجزای تشکیلدهنده خود، بهترتیب جز کدم گروه از مواد محسوب میشوند؟
چای، آلومینیم اکسید و سلنیوم
مخلوط همگن، مخلوط همگن، عنصر
مخلوط ناهمگن، مخلوط همگن، عنصر
مخلوط همگن، ترکیب، عنصر
مخلوط همگن، ترکیب، ترکیب
گزینه سوم، گزینه صحیح است. ماده اول چای است که یک مخلوط است. در واقع چای محلولی از ترکیبات خاصی در آب است، بنابراین از نظر شیمیایی یک ماده خالص محسوب نمیشود.
از طرفی چون ترکیبات این محلول در سراسر آن یکنواخت است، یک ماده مخلوط همگن است. اکسید آلومینیم یک ماده شیمیایی است که یک ترکیب خالص در نظر گرفته میشود. سلنیوم (Se) یکی از عناصر جدول تناوبی است.
کدامیک از موارد زیر یک خاصیت فیزیکی برای آهن محسوب نمیشود؟
آهن در مجاورت هوای مرطوب زنگ میزند.
چگالی آهن $$7.874 gr/{cm}^3$$ است.
آهن خالص نرم است.
آهن در دمای $$1808 K$$ ذوب میشود.
گزینه اول درست است. سه گزینه دیگر بیانگر چگالی، توصیفی از میزان سختی و دمای ذوب ماده آهن هستند که همگی جز خواص فیزیکی آهن محسوب میشوند.
اما گزینه اول خوردگی یا زنگزدگی آهن را بیان کرده است که باعث ایجاد ماده جدیدی به نام زنگ آهن میشود. در نتیجه یک خاصیت شیمیایی است.
کدامیک از تغییرات زیر بهدرستی بیان نشده است؟
آب در حال جوشیدن: یک تغییر فیزیکی
یک محلول سبز رنگ و یک محلول بیرنگ با هم مخلوط میشوند. مخلوط نهایی محلولی با رنگ سبز کمرنگ است: یک تغییر شیمیایی
بخار آب پشت پنجره در هوای سرد به قطرات آب تبدیل میشود: یک تغییر فیزیکی
دو محلول بیرنگ با هم مخلوط میشوند. مخلوط نهایی زرد است: یک تغییر شیمیایی
پاسخ درست گزینه دوم است. گزینه اول تبخیر آب را بیان کرده است که یک تغییر حالت در ماده است و تغییر فیزیکی محسوب میشود. گزینه سوم هم تغییر حالت میعان را توصیف کرده است.
در گزینه آخر دو محلول با دو رنگ مختلف با هم ترکیب شدهاند که چون رنگ محلول نهایی کاملا بیربط با رنگ این دو محلول است، پس تغییر شیمیایی است. با این تفسیر، در گزینه دوم هم انتظار داریم که اگر تغییر شیمیایی رخ داده است، رنگ مخلوط نهایی کاملا با رنگ اجزای اولیه متفاوت باشد. اما رنگ سبز محلول نهایی، همخانوده با رنگ محلول اولیه است. بنابراین گزینه دوم باید یک تغییر فیزیکی باشد نه شیمیایی.
فرآیندی که در آن یک جامد مستقیما به گاز تبدیل میشود، چه نام دارد؟
گزینه سوم صحیح است. میعان تبدیل گاز به مایع است. چگالش عکس تصعید و تبدیل گاز به جامد است. تبرید به معنای سردسازی است و کلا جز تغییر حالتهای یک ماده محسوب نمیشود.
اگر تعدادی قرص نفتالین را در داخل ظرف در بازی قرار دهیم، پس از مدتی ناپدید میشوند. چه اتفاقی برای این قرصها ممکن است رخ داده باشد؟
تبخیر شدهاند.
تصعید شدهاند.
ترکیب شدهاند.
گزینه دوم صحیح است. قرص نفتالین یک جامد است، پس گزینه اول اشتباه است، چون تبخیر تغییر حالت از مایع به گاز است. اینکه قرصها ناپدید شدهاند یعنی به گاز تبدیل شدهاند. اما ذوب، تغییر حالت جامد به مایع است که مایع قابل دیدن است. پس در نهایت میتوانیم بگوییم برای قرص نفتالین تصعید یا تبدیل مستقیم جامد به گاز اتفاق افتاده است.
ترتیب قدرت پیوندهای بینمولکولی در کدام مورد از کمترین به بیشترین نوشته شده است؟
گاز، مایع، جامد
گاز، جامد، مایع
مایع، گاز، جامد
جامد، مایع، گاز
گزینه اول درست است. در گازها قدرت پیوندها کمترین است و در جامدات قویترین پیوندهای بینمولکولی وجود دارد.
کدام جمله درست است؟
پلاسما تغییر حالت ماده از گاز به مایع است.
محلولها جزئی از مواد خالص ترکیبی محسوب میشوند.
عنصر روبیدیوم شامل اتمهای Rb و Cs است.
پوسیدگی نوعی خاصیت شیمیایی است.
گزینه آخر صحیح است. پلاسما حالت چهارم ماده است که از داغ شدن گاز حاصل میشود و مایع نیست. همانطور که گفتیم، محلولها در دستهبندی مواد مخلوط همگن قرار دارند و ماده خالص نیستند. پس این گزینه هم اشتباه است. عنصر روبیدیوم فقط از اتمهای روبیدیوم یا Rb تشکیل شده است. طبق تعریف عنصر، تمام اتمهای یک عنصر باید از یک نوع باشند. پس این گزینه هم غلط است.
نقطه ذوب یک ماده دمایی است که در آن ماده کدام تغییر حالت را دارد؟
از جامد به گاز
از مایع به جامد
از جامد به مایع
از گاز به مابع
گزینه سوم درست است. ذوب تغییر حالت ماده از جامد به مایع است.
source