تمام پروتئینهای بدن ما بهوسیله ژنها کد میشوند و هر تغییر ژن با تغییر ساختار یا عملکرد پروتئین همراه است. این تغییرات ممکن است منجر به اختلال در عملکرد پروتئینها و بیماری شود یا با ایجاد بهبود عملکرد پروتئین همراه باشد. سیستم ایمنی بدن انسان از پروتئینهای زیادی تشکیل شده است که وظیفه آنها شناسایی آنتیژن یا از بین بردن پاتوژنها است. ژنتیک ایمنی ترکیبی از علم ژنتیک و ایمونولوژی است. در این شاخه از زیستشناسی ژن گیرندههای سلولهای ایمنی، آنتیبادیها، گیرندههای شناسایی الگو، نوترکیبیهای ژنتیکی ژن پروتئینهای ایمنی و تغییرات ژنتیکی حین تکامل سلولهای ایمنی بررسی میشود. این علم به پزشکان و محققان کمک میکند دلیل اختلالهای سیستم ایمنی را شناسایی و درمان مناسبی برای آن انتخاب کنند.
گیرنده لنفوسیتهای سیستم ایمنی میلیونها ساختار آنتیژنی متفاوت را شناسایی میکنند و بهطور اختصاصی به آنتیژنها متصل میشوند. این گیرندهها با بازآرایی ژنهای لنفوسیت تولید میشوند. به علاوه تمام سلولهای ایمنی از سلولهای بنیادی مشترک در مغز استخوان تولید میشوند. اما به دلیل تغییرات ژنتیکی شکل و عملکرد متفاوتی دارند. اگر با این مطلب از مجله فرادرس همراه باشید، ابتدا ژنتیک ایمنی را تعریف میکنیم و در ادامه بازآرایی ژن آنتیبادیها و گیرنده آنتیژنی لنفوسیت T، تکامل لنفوسیتهای B و T، کمپلکس سازگاری بافتی اختصاصی انسان و بیماریهای ژنتیکی سیستم ایمنی را بررسی میکنیم. در انتها تعدادی از کتابهای ایمونوژنتیک را برای مطالعه بیشتر علاقهمندان معرفی میکنیم.
ژنتیک ایمنی چیست؟
ژنتیک ایمنی یا ایمونوژنتیک شاخهای از ایمونولوژی است که ارتباط بین سیستم ایمنی و ژنها را بررسی میکند. این علم سنتز آنتیبادیها و گیرندههای اختصاصی آنتیژن، تغییرات ژنتیکی در مسیر تکامل سلولهای ایمنی، ژن پروتئینهای سیستم ایمنی و بیماریهای ژنتیکی سیستم ایمنی را توضیح میدهد. بررسی ژنها در ایمونوژنتیک به طراحی و انتخاب روشهای درمانی کارآمدتر کمک میکند. در این مطلب قصد داریم، ژنهای آنتیبادی و نحوه نوترکیبی آنها، مکانیسم ژنتیکی تکامل لنفوسیتها B و T، ژنها و نحوه نوترکیبی گیرندههای آنتیژنی لنفوسیتهای T، ژن آنتیژنهای لکوسیت انسانی، بیماریهای ژنتیکی سیستم ایمنی را بررسی و چند کتاب در مورد ایمونوژنتیک معرفی کنیم.
ژنتیک آنتی بادی
آنتیبادی یا ایمونوگلوبینها گیرندههای اختصاصی آنتیژن لنفوسیت B هستند. این پروتئینها در غشای لنفوسیت B قرار دارند یا بهوسیله وزیکولهای ترشحی از این سلولها خارج میشوند. آنتیبادیهای ترشحی به آنتیژنهای میکروبی متصل میشوند و مکانیسمهای مختلف سیستم ایمنی را برای از بین بردن پاتوژن فعال میکنند. سیستم ایمنی هر انسان توانایی تولید میلیاردها آنتیبادی اختصاصی برای از بین بردن میکروبهای مختلف را دارد. با توجه به اینکه این تعداد بیشتر از تمام ژنهای انسان است، این سوال پیش میآید که ان تنوع آنتیبادی چگونه در لنفوسیتهای B ایجاد میشود؟ این پروتئینها با نوترکیبی ژنی تولید میشوند. قبل از توضیح نوترکیبی ژنی لنفوسیتهای B در این بخش از مطلب ژنتیک ایمنی چیست، ساختار آنتیبادیها را بررسی میکنیم.
ساختار آنتی بادی
آنتیبادی گلیکوپروتئین بزرگی است که از چهار زنجیره پلیپپتیدی (دو زنجیره سبک و دو زنجیره سنگین) و گروههای کربوهیدرات تشکیل شده است. دو زنجیره سنگین (حدود ۵۳ کیلودالتون | H) آنتیبادی یکسان هستند و بین آنها پیوند دیسولفیدی وجود دارد. آنتیبادیها بر اساس زنجیره سنگین به پنج کلاس یا ایزوتوپ IgM و IgD و IgG و IgA و IgE تقسیم میشود. این کلاسهای پروتئینی در توالی آمینواسیدها، اندازه و کربوهیدراتها با هم تفاوت دارند و بر اساس توالی ثابت زنجیره سنگین شناخته میشوند.
در ساختار زنجیره سنگین ناحیهای به نام لولا وجود دارد. در این ناحیه تعداد زیادی آمینواسید سیستئین و پرولین وجود دارد. سیستئین در تشکیل پیوند دیسولفیدی شرکت میکنند و پرولین از تشکیل ساختار کروی جلوگیری میکند. این ناحیه سبب میشود آنتیبادی ساختار Y شکل تشکیل دهد. هر کلاس بهوسیله توالی ژنی متفاوت کد میشود. به علاوه هر کلاس به زیرکلاسهای مختلف ($$alpha_1$$ و $$alpha_2$$ و $$gamma_1$$ و $$gamma_2$$ و $$gamma_3$$ و $$gamma_4$$) تقسیم میشود. تفاوت این زیرکلاسها تعداد و محل قرار گرفتن پیوند دیسولفیدی است که منجر به تغییر عملکرد آنتیبادی می شود. در جدول زیر نام ژنهای زنجیره سنگین ذکر شده است.
| آنتیبادی | ژن زنجیره سنگین |
| IgM | $$mu$$ |
| IgD | $$delta$$ |
| IgG | $$gamma$$ |
| IgA | $$alpha$$ |
| IgE | $$epsilon$$ |
هر زنجیره سنگین آنتیبادی با پیوندهای دیسولفیدی به یک زنجیره سبک (حدود ۲۲ کیلودالتون | L) متصل میشود. پلیپپتیدهای $$kappa$$ و $$lambda$$ دو کلاس زنجیره سبک در تمام گونهها هستند. اما درصد بیان آنها متفاوت است. دو زنجیره سبک هر آنتیبادی $$lambdalambda$$ یا $$kappakappa$$ است. به این ترتیب نوع زنجیرههای پلیپپتیدی در IgG ممکن است $$2kappa2gamma$$ یا $$2lambda2gamma$$ باشد. زنجیره سبک و سنگین از دومینهای متغیر و ثابت کروی تشکیل شدهاند که بهوسیله زنجیرههای خطی و پیوند دیسولفیدی به هم متصل میشوند. هر زنجیره سبک دو دومین و هر زنجیره سنگین چهار یا پنچ دومین دارد. دومینهای متغیر با $$V_H$$ (زنجیره سنگین) و $$V_L$$ (زنجیره سبک) و دومینهای ثابت را با $$C_H$$ (زنجیره سنگین) و $$$$ (زنجیره سبک) نامگذاری میشود. دومینهای متغیر جایگاه اتصال به آنتیژنها است.
کمپلکس گیرنده آنتیژنی لنفوسیت B از آنتیبادیهای غشایی و دیمر $$Igalpha/Igbeta$$ تشکیل شده است. آنتیبادیهای غشایی به آنتیژن متصل میشوند و دیمر $$Igalpha/Igbeta$$ در انتقال پیام شرکت میکند. $$Igalpha$$ و $$Igbeta$$ دو زنجیره پلیپپتیدی هستند که با پیوند دیسولفیدی به هم متصل میشوند و از بخشهای خارج سلولی، عرض غشایی و سیتوپلاسمی تشکیل شدهاند. بخش سیتوپلاسمی آنها یک موتیف فعالسازی بر پایه تیروزین (ITAMs) وجود دارد که به فعال شدن لنفوسیتهای B کمک میکند.
نوترکیبی ژنی آنتی بادی
در بخش قبلی توضیح دادیم که زنجیره سبک از یک دومین متغیر و یک دومین ثابت تشکیل شده است. این دومینها بهوسیله سه ژن مختلف کد میشوند. ژن V (Variable | متغیر) و J (Joining | اتصال) نواحی متغیر زنجییره سبک و ژن C (Constant | ثابت) ناحیه ثابت این زنجیره را کد میکند. ژنهای کدکننده زنجیره سبک $$kappa$$ در لوکوس $$kappa$$ قرار دارند. در این لوکوس حدود ۴۰ قطعه ژنی $$V_kappa$$ و ۵ قطعه ژنی $$J_kappa$$ و قطعه ژنی $$C_kappa$$ وجود دارد که بهوسیله قطعات DNA از هم جدا میشوند. در تکامل لنفوسیت B در مغز استخوان قطعات ژنی V و J بهوسیله آنزیم ریکامبیناز V(D)J از هم جدا و با ترتیب جدیدی به هم متصل میشوند. برای مثال در شکل زیر ریکامبیناز قطعه ژنی V2 را به J4 متصل میکند.
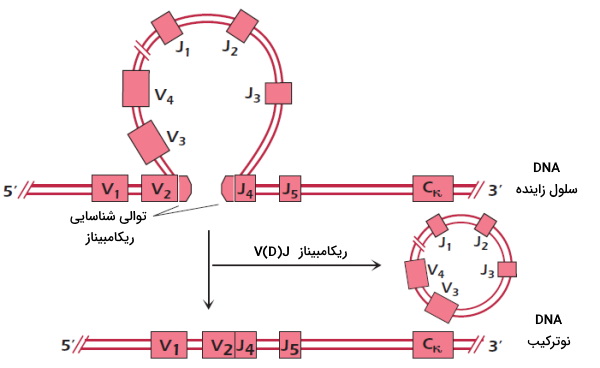
لوکوس $$lambda$$ روی کروموزوم ۲۲ انسان قرار دارد. نوترکیبی زمانی در این ژن ایجاد میشود که نوترکیبی هر دو لوکوس $$kappa$$ تغییرات لازم را ایجاد نکرده است. در این لوکوس حدود ۳۰ اگزون $$Vlambda$$ و 4 چهار اگزون $$Jlambda$$ و ۴ اگزون $$Clambda$$ وجود دارد. برای نوترکیبی این ژن، اگزونهای متفاوت بهوسیله آنزیم ریکامبیناز به هم متصل میشوند.
لوکوس زنجیره سبک روی کروموزوم ۱۴ انسان قرار دارد. دومینهای متغیر این زنجیره بهوسیله قطعههای ژنی $$V_H$$ و $$D_H$$ (Diversity | تنوع) و $$J_H$$ کد میشود. در این لوکوس ژنی حدود ۴۰ ژن $$V_H$$ و ۲۵ ژن $$D_H$$ و ۶ ژن $$J_H$$ کد میشود. در انتهای $$3^prime$$ این لوکوس ژنهای ناحیه ثابت زنجیره سنگین قرار دارد. در این ناحیه ۹ ژن $$C_H$$ برای کلاسها و زیرکلاسها وجود دارد. نوترکیبی زنجیره H مثل زنجیره سبک به کمک ریکامبیناز V(D)J انجام میشود.
در مراحل ابتدایی تکامل لنفوسیت B دو مرحله نوترکیبی ایجاد میشود. در مرحله اول یکی از قطعات ژنی D به یکی از قطعات ژنی V در مرحله دوم قطعه ژنی VD به یکی از قطعات ژنی J متصل میشود. این نوترکیبی اتصال اختصاصی آنتیبادی به آنتیژن را تعیین میکند. در مراحل اولیه تکامل لنفوسیت B قطعه ژنی VDJ با نزدیکترین قطعه ژنی ثابت ($$C_mu$$) رونویسی میشود. به همین دلیل گیرنده سلولهای B نابالغ IgM است. در سلول B بالغ قطعه VDJ با دو با دو قطعه ژنی ثابت نزدیک ($$C_mu$$ و $$C_delta$$) رونویسی میشود. از پیرایش جایگزین mRNA این قطعه ژنی mRNAهای $$VDJC_mu$$ یا $$VDJC_delta$$ ایجاد میشود. به همین دلیل در غشای سلول B بالغ IgM و IgD با جایگاه آنتیژنی مشابه وجود دارد.
IgG و IgA و IgE به همراه IgM، آنتیبادیهای ترشحی هستند که در مراحل بعدی تکامل لنفوسیت B از پلاسموسیتها ترشح میشوند. در این سلولها آنتیبادی غشایی وجود ندارد. آنتیبادیهای ترشحی و غشایی بهوسیله پیرایش جایگزین تشکیل میشود. برای مثال فرض کنید بخشی از اگزونهای انتهایی $$C_mu$$ ناحیه غشایی و سیتوپلاسمی IgM و بخشی از آنها انتهای C آنتیبادی ترشحی را کد میکنند. تمام اگزونها به یک mRNA اولیه ترجمه میشوند که از پیرایش آن یکی از اگزونهای غشایی یا ترشحی در mRNA نهایی وجود دارد و به آنتیبادی ترجمه میشود. اگر به دنبال کسب اطلاعات بیشتر در رابطه با mRNA و RNA هستید، قبلا در مجله فرادرس راجع به آن به صورت کامل صحبت کردهایم که میتوانید مطلب مرتبط با آن را مطالعه و آگاهی بیشتری در این رابطه پیدا کنید.
تغییر کلاس آنتی بادی
تغییر کلاس آنتیبادی مکانیسمی است که در لنفوسیتهای B بالغ به تشکیل ایزوتوپهای آنتیبادی با جایگاه آنتیژنی مشابه کمک میکند. اتصال آنتیژن (+IgD و +IgM) و سیتوکین لنفوسیتهای T به گیرنده سلولهای B بالغ، تغییر کلاس آنتیبادی و نوترکیبی $$C_H$$ را تحریک میکند. در این فرایند جایگاه اتصال به آنتیژن ثابت است اما زنجیره سنگین تغییر میکند. در انتهای $$5^prime$$ تمام ژنهای C به جز $$C_delta$$ توالی نوکلئوتیدی تکراری وجود دارد که جایگاه برش DNA است و در تغییر کلاس همراه قطعات DNA بین ژنی حذف میشود. در نتیجه در mRNA رونویسی شده از این قطعه ژنی تعدادی از ژنهای $$C_H$$ وجود ندارد.
با پیرایش جایگزین mRNA اولیه و ترجمه mRNA نهایی آنتیبادی با زنجیره سنگین متفاوت و جایگاه اتصال به آنتیژن مشابه تولید میشود. کلاسهای متفاوت آنتیبادی مکانیسمهای ایمنی متفاوتی را فعال میکنند. تغییر کلاس آنتیبادی در لایه زاینده اندامهای لنفاوی ثانویه انجام میشود و نوع سیتوکین زنجیره سنگین آنتیبادی را تعیین میکند. تغییر کلاس آنتیبادی در سلولهای B انجام میشود که به کمک لنفوسیتهای T فعال میشوند.
تکامل لنفوسیت B
لنفوسیتهای b سلولهای ایمنی هستند که از تمایز سلولهای بنیادی رده لنفوئیدی در مغز استخوان تولید میشوند. از تمایز سلولهای بنیادی در مغز استخوان، سلولهای پروB تولید میشود. اولین بازآرایی ژنهای زنجیره سنگین آنتیبادی در این سلولها ایجاد میشود. در این مرحله قطعه ژنی $$D_H$$ کنار قطعه ژنی $$J_H$$ قرار میگیرد. در غشای این سلولها گلیکوپروتئینهای CD19 و CD10 وجود دارد. CD19 در تمام ردههای سلول B به جز پلاسموسیتها بیان میشود. در پایان این مرحله سلولهای پروB به سلولهای پریB تمایز مییابد. اگر به یادگیری علم ژنتیک ایمنی علاقهمند هستید و میخواهید اطلاعات بیشتری در این رابطه داشته باشید، پیشنهاد میکنیم از فیلم آموزش ایمونوژنتیک فرادرس کمک بگیرید که لینک آن در ادامه آورده شده است.
در مرحله دوم، تکامل سلولهای B دومین نوترکیبی ژنهای زنجیره سنگین آنتیبادی انجام و قطعه $$D_H J_H$$ به قطعه $$V_H$$ متصل میشود. این قطعه کنار $$C_mu$$ قرار میگیرد و آنتیبادی M در سلولهای پریB بیان میشود. در غشای این سلولها مثل سلولهای پروB گلیکوپروتئینهای CD10 و CD19 وجود دارد. سنتز گیرندههای آنتیژنی لنفوسیت B مهمترین فرایند این مرحله از تکامل سلولهای B است. اگر گیرنده به دلیل اختلال در بازآرایی ژن زنجیره سنگین انجام نشود، سلول B در این مرحله با آپوپتوز از بین میرود. زنجیره سبک گیرنده آنتیژنی این سلولها VpreB و $$lambda_5$$ جایگزین شده است. $$lambda_5$$ و VpreB همراه هم هستند اما پیوند کوالانسی بین آنها وجود ندارد. $$lambda_5$$ با پیوند دیسولفیدی به زنجیره $$mu$$ متصل میشود. در کنار این گیرنده دیمر $$Igalpha/Igbeta$$ قرار دارد. در انتهای این مرحله ژنهای زنجیره سبک گیرنده آنتیژنی بازآرایی و سلولهای پریB به سلولهای B نابالغ تبدیل میشوند.
در مرحله سوم، گیرنده آنتیژنی از اتصال زنجیره سبک به زنجیره $$mu$$ تشکیل میشود و در غشای سلول B نابالغ قرار میگیرد. به علاوه در سلولهای این مرحله و مراحل بعدی گلیکوپروتئین CD20 بیان میشود. سلولهای B نابالغ در این مرحله با انتخاب منفی نسبت به آنتیژنهای سلولهای خودی خنثی میشوند. در این فرایند گیرنده آنتیژنی لنفوسیتها B با آنتیژنهای سطحی سلولهای استرومای مغز استخوان برهم کنش میدهند. اگر بین این گیرندهها و آنتیژن اتصال محکمی ایجاد شود، سلول با آپوپتوز از بین میرود. اما سلولهایی که با این آنتیژنها اتصالی ندارند یا اتصال بسیار ضعیفی دارند وارد مرحله بعدی تکامل میشوند.
در مرحله چهارم، سلول B نابالغ که نسبت به آنتیژنهای خودی خنثی شدهاند، پس از ۲۴ ساعت از مغز استخوان خارج و بهوسیله خون به طحال منتقل میشوند. به لنفوسیتهای B این مرحله، سلولهای B انتقالی گفته میشود. در این مرحله علاوه بر IgM، گیرندههای IgD در سلول بیان میشود. سلولهای B انتقالی اولین لنفوسیتهای B هستند که گیرنده سیتوکین BAFF در آنها بیان میشود. این سیتوکین سیگنال بقای لنفوسیتهای B است که از منوسیتها، سلولهای دندریتی و سلولهای استرومای مغز استخوان ترشح میشود.
در مرحله پنجم، بیان ژن IgD در لنفوسیتها از سلولهای B انتقالی بیشتر است. به لنفوسیتهای این مرحله، سلولهای B بالغ یا اولیه گفته میشود. بعضی از سلولهای B اولیه در گرههای لنفاوی وارد فولیکولها میشوند و به آنها لنفوسیتهای B فولیکولار گفته میشود. بعضی از سلولهای B اولیه وارد ناحیه مارژینال طحال میشوند و به آنها لنفوسیتهای B مارژینال گفته میشود. این سلولها پس از مواجه با آنتیژن در گرههای لنفاوی و طحال به سلولهای B خاطره و پلاسموسیت تمایز مییابد.
- پلاسموسیتها: پلاسموسیتها سلولهای B هستند که آنتیبادی ترشح میکنند. در این سلولها آنتیبادیهای غشایی بیان نمیشوند. دومین متغیر آنتیبادیها با دومین متغیر گیرنده آنتیژن لنفوسیت B در سلولهای B اولیه یکسان است. اما زنجیرههای سنگین متفاوتی دارد. CD19 و CD10 در این سلولها بیان نمیشود. اما در غشای آنها گلیکوپروتئین CD27 وجود دارد.
- سلولهای B خاطره: سلولهای B خاطره فقط زمانی تولید میشوند که سلولهای B اولیه با کمک لنفوسیتهای T فعال شده باشد. دومین متغیر گیرنده آنتیژنی این سلولها با دومین متغیر سلول B اولیه یکسان است اما کلاس آن IgG یا IgA یا IgE است. IgD در این سلولها بیان نمیشود. در غشای این سلولهای گلیکوپروتئین CD27 وجود دارد. این سلولها تقسیم نمیشوند و طول عمر زیادی دارند.
ژن گیرنده لنفوسیت T
لنفوسیتهای T گروهی از سلولهای ایمنی بدن هستند که برخلاف لنفوسیتهای B، سلولهای آلوده به پاتوژن را شناسایی میکنند. در غشای این سلولها گیرندههایی وجود دارد که آنتیژنهای میکروبی را به طور اختصاصی شناسایی میکند. این گیرندهها توانایی شناسایی میلیاردها آنتیژن متفاوت را دارند. تنوع گیرندههای آنتیژنی لنفوسیت T مثل آنتیبادیها بهوسیله نوترکیبی ژنی ایجاد میشود. در این بخش از مطلب مجله فرادرس ابتدا ساختار گیرنده آنتیژنی و در ادامه نوترکیبی ژنهای این گیرنده را بررسی میکنیم. اما اگر به یادگیری بیشتر در مورد ژنتیک ایمنی و ایمونولوژی علاقه دارید، می توانید از فیلمهای آموزشی فرادرس که لینک آنها در ادامه آورده شده است استفاده کنید.
ساختار گیرنده آنتی ژنی لنفوسیت T
ساختار گیرنده آنتیژنی لنفوسیت T شباهت زیادی به آنتیبادیها غشایی لنفوسیت B دارد. این گیرنده از دو زنجیره پلیپپتیدی عرض غشایی تشکیل شده است. در انسان و بیشتر گونهها این زنجیرهها آلفا و بتا و در تعدادی کمی از لنفوسیتها گاما و دلتا هستند. زنجیرههای آلفا و بتا گلیکوپروتئینهایی هستند که در تعداد و نوع کربوهیدراتهای اتصالی تفاوت دارند. بین این دو زنجیره پیوند دیسولفیدی وجود دارد. این زنجیرهها از دومینهای متغیر (V) و ثابت (C) تشکیل میشوند. دومینهای متغیر زنجیره آلفا و بتا کنار هم قرار میگیرند و جایگاه اتصال به آنتیژن را تشکیل میدهند.
کنار گیرنده آنتیژنی لنفوسیت T گلیکوپروتئین CD3 و دو زنجیره پلیپپتیدی زتا وجود دارد که به شناسایی آنتیژنها و فعال شدن لنفوسیت کمک میکند. گلیکوپروتئین CD3 از سه زنجیره پلیپپتیدی $$gamma$$ و $$delta$$ و $$epsilon$$ تشکیل میشود که به شکل دیمرهای $$gammaepsilon$$ یا $$deltaepsilon$$ در غشا قرار میگیرند. ساختار پلیپپتیدیهای گاما و دلتای CD3 با زنجیرههای گام و دلتای گیرنده آنتیژنی لنفوسیت T تفاوت دارد. در بخش سیتوپلاسمی CD3 یک و در بخش سیتوپلاسمی هر زنجیره زتا سه موتیف فعالسازی بر پایه تیروزین دارد که به فعال شدن لنفوسیت T کمک میکند. CD4 و CD8 کمکگیرندههای لنفوسیت T هستند که گیرندههای $$alphabeta$$ دارند. این مولکولها به پروتئينهای MHCI و MHCII متصل میشوند و به شناسایی آنتیژن کمک میکنند.
نوترکیبی ژنی گیرنده آنتی ژنی لنفوسیت T
ژنهای گیرنده لنفوسیت T عضوی از ابرخانواده ایمونوگلوبینها است. ژنهای زنجیره $$alpha$$ و $$delta$$ در یک لوکوس مشترک و ژنهای زنجیره $$beta$$ و $$gamma$$ در لوکوسهای متفاوتی قرار دارند. ژن زنجیره $$alpha$$ و $$gamma$$ از قطعات V و J و ژن زنجیرههای $$beta$$ و $$delta$$ از قطعات V و D تشکیل شده است. تعداد ژنهای دومین متغیر زنجیرههای آلفا و بتا (حدود ۴۰ تا ۵۰ ژن) از تعداد ژنهای دومین متغیر زنجیرههای گاما و دلتا (حدود ۵ تا ۱۰ ژن) بیشتر است. دومین ثابت زنجیرههای آلفا، دلتا و گاما بهوسیله یک قطعه ژنی و دومین ثابت زنجیره بتا بهوسیله دو دومین ژنی ($$Cbeta_1$$ و $$Cbeta_2$$) کد میشود. عملکرد $$Cbeta_1$$ و $$Cbeta_2$$ تفاوتی با هم ندارد.
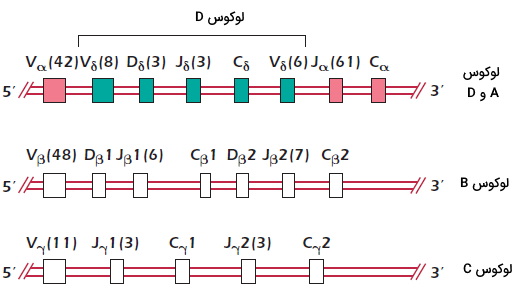
نوترکیبی با مکانیسمهای مشابه لنفوسیت B ذدر ژنهای گیرنده آنتیژنی لنفوسیت T ایجاد میشود. در این سلولها آنزیم ریکامبیناز V(D)J به تغییر ترکیب قطعات ژنی کمک میکند و پیرایش جایگزین mRNA قطعات ژنی متفاوتی را کنار هم قرار میدهد. به علاوه حین برش و اتصال دوباره قطعات ژنی ممکن است چند نوکلئوتید به محل اتصال اضافه یا کم شود. این تغییرات به ایجاد تنوع در جایگاه اتصال به آنتیژن کمک میکند.
تکامل لنفوسیت T
لنفوسیتهای T مثل لنفوسیتهای B از تمایز سلولهای بنیادی لنفوئیدی در مغز استخوان تولید میشوند. اما برخلاف لنفوسیتهای B در غده تیموس بالغ میشوند. تیموس بافت لنفاوی است که در قفسه سینه قرار دارد. سلولهای اجدادی T از مغز استخوان به ناحیه قشر تیموس منتقل میشوند. در غشای این سلولها گلیکوپروتئینهای CD4 و CD8 وجود ندارد. بازآرایی ژنهای گیرنده آنتیژنی لنفوسیت T در این مرحله شروع میشود. در این مرحله مشخص میشود که گیرندههای لنفوسیت T از نوع $$alphabeta$$ یا $$gammadelta$$ باشد. ژن آلفا و بتا در سلولهایی که ژنهای دلتا و گامای آنها بیان شده است، خاموش میشود. در این سلولها CD3 و زنجیرههای زتا در غشای قرار میگیرد و سلولها از تیموس به بافتهای اپیتلیال بدن منتقل می شوند.
در بعضی از سلولهای اجدادی ژن بتا بیان میشود. به این لنفوسیتها، سلولهای پریT گفته میشود. زنجیره بتا در این سلولها با زنجیره پری $$T_alpha$$، گلیکوپروتئین CD3 و زنجیرههای زتا جفت میشود و در غشای سلول قرار میگیرد. پری $$T_alpha$$ برخلاف زنجیره آلفا، پروتئینی یکسان در تمام لنفوسیتهای T است. سلولهای اجدادی که گیرندههای آنتیژنی لنفوسیت T در آنها بیان نمیشود با آپوپتوز از بین میروند. پس از قرار گرفتن گیرنده آنتیژنی اولیه در غشا، بیان ژن پری $$T_alpha$$ کاهش میيابد و آنزیمهای ریکامبیناز بازآرایی ژنهای زنجیره آلفا را شروع میکنند.
ژنهای زنجیره آلفا بین ژنهای زنجیره دلتا قرار دارد. در بازآرایی ژنهای آلفا، ژنهای دلتا حذف میشود. به همین دلیل لنفوسیت نمیتواند همزمان زنجیره آلفا و دلتا را بیان کند. در مرحله بعدی تکامل لنفوسیتهای T ، کمکگیرندههای CD4 و CD8 در سلولهای T بیان میشود. در مرحله آخر این سلولها با انتخاب مثبت و منفی به انواع لنفوسیتهای T تقسیم میشوند.
انتخاب مثبت
در انتخاب مثبت سلولهای T که کمکگیرندههای CD4 و CD8 دارند با آنتیژنهای خودی متصل به مولکولهای MHCI و MHCII در غشای سلولهای اپیتلیال قشر تیموس برهمکنش میدهند. سلولهایی که گیرنده آنتیژنی و کمکگیرندههای آنها اتصال ضعیفی با آنتیژن-MHC دارند، وارد مرحله بعدی تکامل میشوند و سلولهایی که گیرنده آنتیژنی و کمکگیرندههای آنها اتصالی با آنتیژن-MHC ندارند با آپوپتوز از بین میروند. در این مرحله بیان CD4 در سلولهایی که با MHCI اتصال قویتری دارند و بیان CD8 در سلولهایی که با MHCII اتصال قویتری دارند، کاهش مییاید. در نتیجه سلولها به دو دسته $$CD8^+$$ و $$CD4^+$$ تقسیم میشوند.
انتخاب منفی
در انتخاب منفی، سلولهای T از بین میروند که ممکن است نسبت به سلولهای خودی بدن پاسخ ایمنی ایجاد کنند. سلولهای T باقیمانده از انتخاب مثبت با آنتیژنهای متصل به مولکولهای MHC سلولهای دندریتی تیموس یا سلولهای اپتلیال مدولا برهمکنش میدهد. در این فرایند سلولهای T حذف میشوند که با آنتیژن متصل به MHC برهمکنش قوی میدهند. این سلولها پس از انتخاب منفی از تیموس خارج و به اندامهای لنفاوی ثانویه منتقل میشوند. سلولهای T اولیه طول عمر زیادی دارند.
تکامل لنفوسیت T خارج از تیموس
سلولهای CD4 و CD8 پس از اتصال به آنتیژن در اندامهای لنفاوی ثانویه فعال میشوند. سلولهای CD4 یا سلولهای T کمککننده سیتوکینهایی ترشح میکنند که در فعال شدن سلولهای B و گلبولهای سفید دیگر نقش دارند. سلولهای CD8، با القای آپوپتوز سلولهای آلوده به ویروس یا توموری را از بین میبرند. بخش بسیار کمی از سلولهای T فعال به سلولهای T خاطره تبدیل میشوند و برای مدت طولانی در بدن باقی میمانند.
تکامل سلول های T کشنده طبیعی
«سلولهای T کشنده طبیعی» (Killer T Cells | NKT) گروهی از لنفوسیتهای T هستند که حدود ۱٪ گلبولهای سفید تکهسته را تشکیل میدهند. در غشای این سلولها علاوه بر گیرنده آنتیژنی لنفوسیت T، پروتئینهای NK1.1 وجود دارد. این سلولها آنتیژنهای گلیکولیپی متصل به CD1d را شناسایی میکنند. سلولهای کشنده طبیعی فعالیت سایر لنفوسیتهای T را تنظیم میکنند و در کنترل بیماریهای خودایمنی، سرطان و عفونتها نقش دارند. این سلولها از تمایز سلولهای اجدادی لنفوسیت T در تیموس تولید می شوند. در این سلولها بازآرایی ژنهای گیرنده آنتیژنی لنفوسیت T سبب ایجاد گیرندههایی میشود که با آنتیژن متصل به NK1.1 برهمکنش میدهند. این سلولها در ایمنی ذاتی و اکتسابی نقش دارند.
این سلولها با سلولهای کشنده طبیعی (Natural Killer (NK) Cells) که در مغز استخوان تمایز مییابند تفاوتهایی دارد. در سلولهای NK، گیرندههای آنتیژنی لنفوسیت T وجود ندارد. این سلولهای در ایمنی ذاتی بدن نقش دارند. CD16 و CD56 فاکتورهای تمایز سلولهای کشنده طبیعی از سایز لنفوسیتها است.
تکامل لنفوسیت های T تنظیمی
لنفوسیتهای T تنظیمی (Treg) حدود ۱۰٪ لنفوسیتهای CD4 بافتهای لنفاوی را تشکیل میدهند. این سلولها فعالیت سایر لنفوسیتهای T را تنظیم میکنند. پروتئینهای CD25 و فاکتور رونویسی Foxp3 پروتئینهای تمایزی این سلولها از سایر لنفوسیتهای T است. این سلولها کمپلکس آنتیژن خودی-MHC خودی را شناسایی میکنند اما در انتخاب منفی تیموس از بین نرفتهاند.
ژن آنتی ژن لکوسیت انسان
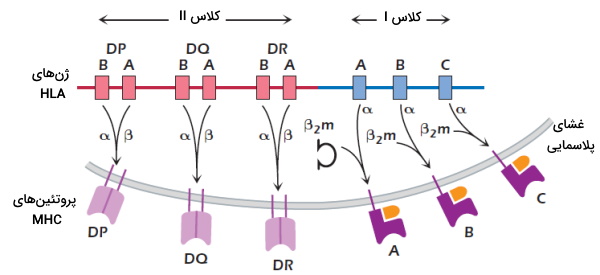
«کمپلکس سازگاری بافت اصلی» (Major Histocompatibility Complex | MHC) مجموعهای از پروتئینهای غشایی است که در فعال شدن سلولهای ایمنی نقش دارند. این پروتئینها در انسان بهوسیله مجموعه ژنی «آنتیژن لکوسیت انسان» (human leukocyte antigen | HLA) کد میشود. آنتیژنها پس از پردازش بهوسیله این پروتئینها در غشای سلول قرار میگیرند. لنفوسیتهای T آنتیژن متصل به این پروتئینهار ا شناسایی میکنند. آنتیژنهای خارجی، عوامل بیماریزا یا عوامل غیربیماریزایی هستند که سیستم ایمنی را تحریک میکنند. این پروتئینها به دو گروه MHCI و MHCII تقسیم میشوند. ساختار این پروتئینها بین افراد مختلف، متفاوت است. در ادامه این مطلب ابتدا ساختار کلی MHCI و MHCII را توضیح میدهیم و در ادامه نقش آنها در سیستم ایمنی و ژنهای MHC را بررسی میکنیم.
ساختار MHCI
پروتئینهای MHCI در غشای تمام سلولهای هستهدار بدن وجود دارد. این پروتئینها به CD8 و پروتئینهای غشایی سلولهای کشنده طبیعی متصل میشوند. بیان این پروتئينها در پاسخ به اینترفرون آلفا، بتا و گاما افزایش مییابد. MHCI یک گلیکوپروتئین عرض غشایی است که بهوسیله پیوندهای غیرکوالانسی به زنجیره پلیپپتیدی $$beta_2$$ میکروگلوبین متصل است. ساختار و توالی آمینواسیدی $$beta_2$$ میکروگلوبین در تمام مولکولهای MHCI ثابت است و ژن آن روی کروموزوم دیگری قرار دارد.
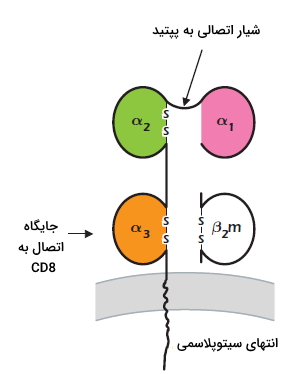
MHCI از یک زنجیره پلیپپتیدی آلفا با سه دومین شبیه آنتیبادیها تشکیل شده است. دومین $$alpha_1$$ در بخشهای خارجی با دومین $$alpha_2$$ و دومین $$alpha_3$$ در نزدیکی غشای پلاسمایی با $$beta_2$$ میکروگلوبین جفت میشود. شیار ایجاد شده از جفت شدن $$alpha_1$$ و $$alpha_2$$ محل اتصال آنتیژن پردازش شده و پپتیدهای کوچک است. توالی آمینواسیدهای این شیار بسیار متنوع است. هر شیار ممکن است به چند نوع پپتید متصل شود. اما همزمان به بیش از یک پپتید متصل نمیشود. دومین $$alpha_3$$ در MHCIهای مختلف شباهت زیادی دارد و CD8 به این ناحیه متصل میشود.
اتصال MHCI به آنتی ژن
MHCI آنتیژنهای پاتوژنهای داخل سلولی را به غشای پلاسمایی منتقل میکند. پروتئینهای پاتوژنهای داخل سلولی (ویروس، باکتری و انگلها) بهوسیله پروتئازهای سیتوپلاسمی تجزیه میشود. بعضی از پروتئینها کاملا تجزیه میشوند و بعضی از آنها به پپتیدهای کوچکتر تقسیم میشوند. پپتیدهای کوچکتر بهوسیله ناقلهای پروتئینی به لومن شبکه اندوپلاسمی منتقل و به MHCI همراه $$beta_2$$ میکروگلوبین متصل میشوند. در ادامه MHCII-پپتید-$$beta_2$$ میکروگلوبین بهوسیله وزیکولها به دستگاه گلژی و از این اندامک به غشای پلاسمایی منتقل میشود.
فعال شدن سلول های CD8
پیام اول فعال شدن سلولهای CD8 اتصال آنتیژن به گیرنده آنتیژنی سلول T، پیام دوم آن اتصال MHCI به CD8 و پیام سوم آن اتصال سیتوکینها به گیرندههای سلولی است. اتصال این پروتئینها با فعال شدن مسیرهای آنزیمی در سیتوپلاسم همراه است که در نهایت فاکتورهای رونویسی را فعال میکند و بیان ژنها را تغییر میدهد. این سلولها پس از فعال شدن به لنفوستهای T تبدیل میشوند. لنفوسیتهای T کشنده به آنتیژنهای متصل به مولکولهای MHCI سلولهای آلوده متصل میشود. این سلولها بهوسیله آزاد کردن گرانولها و اتصال به گیرنده Fas در سلول هدف مرگ سلولی یا آپوپتوز القا میکنند.
در گرانول سلولهای CD8 پرفورین و گرانزیم وجود دارد. پرفورینها پروتئینهایی هستند که در غشای سلول میزبان کانال ایجاد میکنند و نفوذپذیری غشا به یونها را تغییر میدهند. در نتیجه تعادل اسمزی سیتوپلاسم و مایع خارج سلولی به هم میخورد و سلول لیز میشود. گرانزیم پروتئین کینازی است که از کانالهای پرفورینی وارد سلول میشود و پروتئینهای مسیر آپوپتوز را فعال میکند. در مسیر دوم پروتئین FasL به گیرنده Fas در غشای سلولهای هدف متصل میشود. اتصال Fas-FasL منجر به فعال شدن آنزیمها کاسپاز و آپوپتوز سلول میشود.
ساختار MHCII
پروتئینهای MHCII در غشای سلولهای ارائهکننده آنتیژن (سلولهای دندریتی، ماکروفاژها و لنفوسیت B) و سلولهای اپیتلیال غده تیموس وجود دارد. سلولهای ارائهکننده آنتیژن، آنتیژنها را پس از پردازش در اختیار سلولهای T قرار میدهند. اینترفرون گاما بیان این پروتئين در سلولهای فیبروبلاست و سلولهای اندوتلیال را تحریک میکند و بیان آن در سلولهای ارائهکننده آنتیژن را افزایش میدهد.
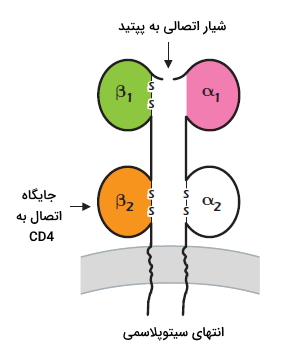
MHCII گلیکوپروتئین عرض غشایی است که از یک زنجیره آلفا و یک زنجیره بتا و چهار دومین $$alpha_1$$ و $$alpha_2$$ و $$beta_1$$ و $$beta_2$$ تشکیل شده است. دومین $$alpha_1$$ در بخشهای دور از غشا با دومین $$beta_1$$ و دومین $$alpha_2$$ در بخشهای نزدیک غشا با دومین $$beta_2$$ جفت میشود. شیار ایجاد شده از جفت شدن دمینهای $$alpha_1$$ و $$beta_1$$ محل اتصال پپتید است. پپتیدهای اتصالی به MHCII بزرگتر از پپتیدهای اتصالی به MHCI است. دومین $$beta_2$$ این مولکولها شباهت زیادی به هم دارد و به CD4 متصل میشود.
اتصال MHCII به آنتی ژن
MHCII آنتیژن پاتوژنهای خارج سلولی را به غشای سلولها منتقل میکند. آنتیژنهای خارجی بهوسیله وزیکولهای فاگوسیتوز وارد سیتوپلاسم سلولهای ارائهدهنده آنتیژن میشود. وزیکول فاگوسیتوزی با اندزوم و اندوزوم با لیزوزوم سلول ادغام میشود. pH پایین اندوزومها و پروتئاز لیزوزوم آنتیژن پروتئینی را تجزیه میکند. این وزیکولها در پایان با وزیکولهای حاوی MHCII ادغام میشود.
زنجیره آلفا و بتای MHCII پس از سنتز در شبکه اندوپلاسمی با هم و پروتئین CD74 جفت میشوند. CD74 پپتیدی یکسان در تمام MHCIIها است که به شیار پپتیدی متصل میشود و از اتصال پروتئینهای شبکه اندوپلاسمی به آن جلوگیری میکند. MHCII-CD74 از شبکه اندوپلاسمی به دستگاه گلژی بخشی از CD74 از MHCII جدا میشود. سپس وزیکول حاوی MHCII با اندوزوم یا لیزووزم حاوی آنتیژن ادغام میشود. در مرحله بعد پروتئین HLA-DM جابهجایی باقیمانده CD74 با پپتیدهای آنتیژنی را کاتالیز میکند. در ادامه وزیکول به غشا منتقل میشود و MHCII-پپتید در غشا قرار میگیرد.
فعال شدن سلول های CD4
فعال شدن سلولهای CD4 به برهمکنش بین مولکولهای MHCII و CD4، برهمکنش مولکولهای کمکتحریکی و مولکولهای چسبنده لنفوسیتها با سلولهای ارائهدهنده آنتیژن بستگی دارد. اتصال مولکولهای MHCII به CD4 و آنتیژن به گیرنده آنتیژنی لنفوسیت T، اولین پیام فعال شدن سلولهای CD4 است. اتصال CD4 به MHCII آستانه تحریک سلول نسبت به آنتیژن را کاهش میدهد. در این حالت سلول T با تعداد کمتر آنتیژن پاسخ ایمنی ایجاد میکند. اتصال پروتئینهایB7 سلولهای ارائهدهنده آنتیژن به پروتئین CD28 سلولها T و اتصال CD40 سلولهای ارائهدهنده آنتیژن به لیگاند CD40 سلولهای T دومین پیام فعال شدن سلولهای CD4 است.
برهمکنش مولکولهای چسبنده، پایداری اتصال دو سلول را افزایش میدهد. در این حالت سلولها برای چند ساعت به هم متصل هستند. فعال شدن سلولهای CD4 با واکنشهای آنزیمی درونسلولی، تغییر آرایش اسکلت سلولی، تغییر آرایش غشای پلاسمایی، تغییر بیان ژن و تمایز سلولهای CD4 به سلولهای عملکننده همراه است.
پس از اتصال سلولهای T و ارائهدهنده آنتیژن فسفاتاز CD45 گروههای فسفات تیروزین کیناز Fyn و Lck را جدا میکند و این آنزیمها فعال میشوند. فسفوکیناز Fyn به انتهای سیتوپلاسمی CD3 و زنجیرههای زتا و فسفوکیناز Lck به انتهای سیتوپلاسمی CD4 متصل است. Fyn و Lck به جایگاه فعالکننده بر پایه تیروزین فسفات اضافه میکنند. ITAM-فسفات جایگاه اتصال تیروزین کیناز ZAP-70 است. Lck کیناز ZAP-70 متصل به ITAM را فسفوریله و فعال میکند. ZAP-70 پروتئین اتصالی برای فعال شدن سلول T (پروتئين LAT) را فسوریله میکند.
LAT فعالیت آنزیمی ندارد اما جایگاه اتصال بسیاری از آنزیمها و پروتئینهای انتقال پیام است. یکی از پروتئینهای اتصالی به LAT، پروتئین SLP76 است که تغییر آرایش اکتینهای اسکلت سلولی را تحریک میکند. این پروتئین به فسفولیپاز $$C_gamma1$$ متصل میشود. فعال شدن فسفولیپاز $$C_gamma1$$ از سه مسیر بیان ژن سیتوکینها و گیرندههای سلولی را تغییر میدهد.
- فسفولیپاز $$C_gamma1$$ فسفاتیدیل اینوزیتول بیس فسفات غشا را به اینوزیتول تریفسفات و دیآسیل گلیسرول تجزیه میکند. این اینوزیتول تریفسفات، غلظت کلسیم سیتوپلاسم را افزایش میدهد. کلسیم پروتئین کلسینورین در سیتوپلاسم و این پروتئین فاکتور رونویسی NFAT را فعال میکند.
- دیآسیل گلیسرول پروتئین کیناز C و این آنزیم فاکتور رونویسی $$NF-kappa B$$ را فعال میکند.
- فعال شدن «پروتئین کینازهای میتوژنی» (mitogen-activated protein (MAP) kinase) است. در این مسیر کینازهای فعال شده بهوسیله دیآسیل گلیسرول در نهایت فاکتور رونویسی AP-1 را فعال میکند.
IL2 یکی از سیتوکینهایی است که بیان آن با فعال شدن سلولهای T افزایش مییابد. این سیتوکین فاکتور رشد سلولهای CD4 است که تقسیم سلول و تشکیل کلونی را تحریک میکند. به علاوه بیان پروتئینهایی که سبب ماندن لنفوسیتهای T در گرههای لنفاوی میشود، کاهش مییابد. در نتیجه لنفوسیتهای عملکننده از گرههای لنفاوی خارج و به بافت آلوده منتقل میشوند. پاسخ ایمنی لنفوسیت T با فیدبک منفی سیتوکینها پایان مییابد. ترشح سیتوکین و فعال کردن سلولهای T وظیفه اصلی لنفوسیتهای CD4 است.
ژن HLA در ژنتیک ایمنی
تنوع مولکولهای MHC به این دلیل ایجاد میشود که این پروتئینها بهوسیله ژنهای متفاوت (پلیژنسیتی) با اللهای متفاوت (پلیمورفیسم) کد میشوند. مولکولهای MHCI بهوسیله ژنها HLA-A و HLA-B و HLA-C و مولکولهای MHCII بهوسیله ژنهای HLA-DP و HLA-DQ و HLA-DR در کمپلکس ژنی HLA کد میشوند. هر ژن کلاس II از یک بخش A و یک بخش B تشکیل شده است. بخش A ژنهای زنجیره آلفا و بخش B ژنهای زنجیره بتا را کد میکند. در هر سلول دو ست از کروموزومهای انسان وجود دارد. به همین دلیل در هر سلول حداقل ۶ کلاس MHCI و ۶ کلاس MHCII بیان میشود. برای هر ژن HLA صدها الل وجود دارد که منجر به ایجاد تنوع در مولکولهای MHC میشود. برخلاف تنوع MHC بین افراد مختلف، MHC تمام سلولهای یک فرد یکسان است.
ژنتیک نقص ایمنی
نقص ایمنی به شرایطی گفته میشود که سلولهای سیستم ایمنی کارایی لازم برای مقابله با پاتوژنها را ندارد. این شرایط ممکن است به دلیل اختلال در رشد و تمایز سلولهای ایمنی، سنتز پروتئینهای مسیر فعال شدن سلول و از بین بردن پاتوژنها یا برهمکنش سلولها ایجاد شود. این اختلالها به دلیل جهش ژن سلولهای ایمنی ایجاد میشود. در این بخش از مطلب تغییرات ژنتیکی انواع نقص ایمنی را بررسی میکنیم. اگر به اطلاعات بیشتر در مورد مکانیسم جهشها و بیماریهای ژنتیکی نیاز دارید، مشاهده فیلمهای آموزشی فرادرس که لینک آنها در ادامه آورده شده است به شما پیشنهاد میشود.
دلایل ایجاد بیماریهای نقص ایمنی با بیماریهای خودایمن و نئوپلاسمهای (سرطان) سلولهای ایمنی تفاوت دارد. در بیماریهای خودایمن بدن علیه سلولهای خودی پاسخ ایمنی ایجاد میکند و در نئوپلاسم تعداد سلولهای ایمنی افزایش مییابد. اما کاهش فعالیت برخی از سلولها در نقص ایمنی ممکن است منجر به نئوپلاسم سلولهای دیگر برای جبران نقص و بیماریهای خودایمنی شود. اختلالهای نقص ایمنی به دو دسته اولیه و ثانویه تقسیم میشود. بیماریهای نقص ایمنی اولیه به دلیل اختلالهای ژنتیکی و بیماریهای نقص ایمنی ثانویه در اثر ابتلا به بیماریهای دیگر ایجاد میشود. به علاوه، سندروم نقص ایمنی اکتسابی به دلیل آلودگی با ویروس HIV بهوجود میآید.
ژنتیک نقص ایمنی اولیه
بیماریهای نقص ایمنی به ندرت اتفاق میافتد. جهش ژنتیکی در سلولهای اولیه مغز استخوان یکی از دلایل اولیه نقص ایمنی است. هر چه جهش در ردههای پایینتر این سلولها ایجاد شود، در مسیرهای ایمنی بیشتر نقص ایجاد خواهد شد. در این بخش از مطلب مجله فردارس ژنتیک «نقص ایمنی مرکب شدید» (Severe Combined Immunodeficiency Diseases | SCID)، اختلالهای نقص ایمنی وابسته به لنفوسیتهای T، اختلالهای نقص ایمنی آنتیبادی و لنفوسیتهای B، اختلالهای ارتباط سلولهای T و B، اختلالهای فاگوسیتها و اختلالهای سیستم کمپلمان را توضیح میدهیم.
نقص ایمنی مرکب شدید
در این سندروم ایمنی هومورال و سلولی فرد مختل میشود. احتمال ابتلای این بیماران به انواع میکروبها بیشتر از افراد دیگر است. واکسیناسیون نوزادان مبتلا به SCID با میکروب ضعیف شده کشنده است. بهترین روش درمان این نقص ایمنی پیوند مغز استخوان از خواهر یا برادر با HLA مشابه است. بیماران مبتلا به SCID را میتوان بر اساس لنفوسیتها به گروههای $$T^-B^+$$ و $$T^-B^-$$ و $$T^+B^+$$ و $$T^+B^-$$ تقسیم کرد. جهش ZAP-70 یکی دیگز از انواع نقص ایمنی مرکب شدید است.
- بیماران $$T^-B^+$$ لنفوسیت T ندارند. لنفوسیتهای B عملکرد ندارند اما تعداد آنها طبیعی است یا افزایش یافته است. این اختلال به دلیل جهش گیرنده زنجیره گامای گیرنده اینترلوکین یا جهش آنزیم JAK3 ایجاد میشود. آنزیم JAK3 به انتقال پیام گیرنده اینترلوکین کمک میکند. جهش زنجیره گاما وابسته به X و جهش آنزیم JAK3 اتوزومی مغلوب است.
- بیماران $$T^-B^-$$ لنفوسیتهای B و T را ندارند. این اختلال به دلیل جهش ژن آنزیم آدنوزین دیآمیناز، پورین نوکلئوزید فسفوریلاز یا ریکامبیناز ایجاد میشود. جهش این آنزیمها اتوزومی مغلوب است. آدنوزین دیآمیناز و پورین فسفوریلاز آنزیمهای مسیر تجزیه نوکلئوتیدها هستند و جهش آنها منجر به تجمع ترکیبات اضافی در سلول میشود. جهش ژن آنزیمهای ریکامبیناز سلولها را در مرحله پری B و پری T متوقف میکند.
- تعداد کمی از بیماران $$T^+B^+$$ هستند و هر دو لنفوسیت را دارند.
- اختلال $$T^+B^-$$ بسیار نادر است. در «سندروم لنفوسیت برهنه» (Bare Lymphocyte Syndrome) هر دو لنفوسیت وجود دارند و تعداد آنها طبیعی است. این سندروم به دلیل جهش در ژن HLA ایجاد میشود. نقص ایمنی در بیمارانی مشاهده میشود که ژن MHCII آنها جهش یافته است.
- جهش ZAP-70 در لنفوسیتهای T بالغ منجر به مهار انتقال پیام گیرنده آنتیژنی لنفوسیت T میشود. جهش این آنزیم از نوع اتوزومی مغلوب است و تعداد لنفوسیتهای CD8 را کاهش می دهد.
اختلال وابسته به لنفوسیت T
بیماران مبتلا به بیماریهای نقص ایمنی وابسته به لنفوسیت B، به عفونتهای قارچی و ویروسی حساستر هستند. یکی از وظایف سلولهای T فعال کردن لنفوسیت B است. در نتیجه نقص عملکرد این سلولها، ترشح آنتیبادی را کاهش میدهد. «سندروم دی جورج» (DiGeorge Syndrome) یا آپلازی تیموس بدو تولید یکی از اختلالهایی است که به دلیل نقص عملکرد لنفوسیتهای T ایجاد میشود. در این بیماری رشد تیموس و اندامهای لنفاوی دیگر مختل میشود. کاهش رشد تیموس تعداد لنفوسیتهای T بالغ را کاهش میدهد و منجر به نقص ایمنی میشود. این بیماری ژنتیکی ارثی نیست و به دلیل جهش حذف در کروموزوم ۲۲ ایجاد میشود. در این بیماران تغییر کلاس آنتیبادی اتفاق نمیافتد و تمام آنتیبادیهای ترشحی از نوع IgM است.
اختلال وابسته به آنتیبادی و لنفوسیت B
بیماری بروتون یکی از انواع نقص ایمنی وابسته به لنفوسیت B است. در این بیماری تمایز سلولهای پری B به سلولهای بالغ مهار میشود. در این بیماری ژن BTK روی کروموزوم X جهش مییابد که آنزیم تیروزین کیناز سیتوزولی کد میکند. این آنزیم در انتقال پیام گیرندههای لنفوسیت B نقش دارد. این بیماری منجر به عفونتهای باکتریایی مکرر در نوزادان میشود.
اختلال ارتباط لنفوسیت B و T
سندروم افزایش IgM و «دونکان» (Duncan Syndrome) به دلیل اختلال در ارتباط لنفوسیت B و T ایجاد میشود. در سندروم افزایش IgM ژن CD40L روی کروموزوم X سلولهای T کمککننده، ژن CD40 سلولهای ارائهدهنده آنتیژن روی کروموزومهای اتوزومی یا پروتئینهای فعالکننده فاکتور رونویسی $$NFkappa B$$ روی کروموزوم X جهش مییابد. در نتیجه جهش CD40L و CD40 اتصال سلول B به لنفوسیتهای T کمککننده و تغییر کلاس آنتیبادی مختل میشود. سندروم دونکان به دلیل به جهش ژن پروتئین همراه فعالکننده پیامرسانی در لنفوسیت T (پروتئین SAP) روی کروموزوم X ایجاد میشود. این پروتئین در لنفوسیتهای B و T، لنفوسیتهای کشنده طبیعی، ائوزینوفیلها و پلاکتها بیان میشود.
اختلال فاگوسیت ها
جهش در ژنهای مختلف منجر به اختلال در حرکت و مهاجرت فاگوسیتها به بافت آلوده، فاگوسیتوز و ادغام با لیزوزوم یا ترشح مزمن گرانولهای سیتوپلاسمی میشود. در نقص چسبندگی لکوسیتها (LAD) اتصال این سلولها به سلولهای اندوتلیال رگ مختل میشود. LAD1 بیماری اتوزومی مغلوب و یکی از انواع نقص چسبندگی لکوسیتها است. این اختلال به دلیل جهش در ژن زیرواحد بتای اینتگرینهای لکوسیتها ایجاد میشود. این ژن روی کروموزوم ۲۱ گرانولوسیتها، مونوسیتها و لنفوسیتها قرار دارد. تعداد گلبولهای سفید بیماران مبتلا به LAD1 در خون زیاد است اما عملکرد لازم را ندارند.
این بیماران به عفونتهای باکتریایی مکرر مبتلا میشوند. در LAD3 دو زنجیره اینتگرین بیان میشود اما با اتصال به پروتئینهای سلولهای اندوتلیال فعال نمیشود. در نتیجه لکوسیتها روی دیواره مویرگ حرکت میکنند اما وارد بافت آلوده نمیشوند. LAD2 به دلیل نقص سلکتین ایجاد میشود. در این بیماری متابولیسم فوکوز مختل میشود و در زنجیره کربوهیدرات سلکتینها فوکوز وجود ندارد. به همین دلیل گلبولهای سفید نمیتوانند روی دیواره مویرگها حرکت کنند.
«سندروم چدیاک هیگاشی» (Chédiak–Higashi Syndrome) یک بیماری اتوزومی مغلوب است که به جهش ژن LYST ایجاد میشود. این ژن در پروتئینی کد میکند که در انتقال پروتئینها و اندامکهای سلولی نقش دارد. این جهش منجر به مهار آزاد شدن گرانولها و ادغام فاگوزوم با لیزوزوم در نوتروفیلها میشود. در بیماری گرانولوماتوز مزمن، مرحله آخر تجزیه باکتری فاگوسیتوز شده مهار میشود و باکتری به شکل گرانول در سیتوپلاسم باقی میماند. جهش در پروتئین هر یک از زیرواحدهای NADPH اکسیداز منجر به گرانولوماتوز مزمن میشود.
اختلال سیستم کمپلمان
سیستم کمپلمان مجموعهای از پروتئینهای سیستم ایمنی است که در اپسوزیناسیون، لیز کردن باکتریها و حذف کمپلکس آنتیزن-آنتیبادی از خون نقش دارد. ژن پروتئینهای کمپلمان روی کروموزومهای اتوزومی قرار دارد. جهش این ژنها ممکن است مراحل اولیه، مراحل انتهایی یا تنظیم این سیستم را مختل کند. جهش پروتئینهای C1 و C4 و C2 مسیر کلاسیک و جهش C3مسیر جایگزین سیستم کمپلمان را مختل میکند. این جهشها ابتلا به عفونتهایی که بهوسیله باکتریهای کپسولدار ایجاد میشود را افزایش میدهد.
به علاوه نقص سیستم کمپلمان توانایی بدن برای پاکسازی مولکولهای ایمنی را کاهش و ابتلا به بیماریهای خورایمنی به ویژه بیماریهای رماتیسمی را افزایش میدهد. جهش لکتین اتصالی به مانوز که بدون نیاز به آنتیبادی مسیر کلاسیک را فعال میکند، احتمال ابتلا به عفونتهای باکتریایی را افزایش میدهد. جهش در ژن پروتئینهای انتهایی سیستم کمپلمان (C5-C9) تشکیل کمپلکس حمله به غشا را مهار میکند. این کمپلکس نقش مهمی در از بین بردن باکتریهای گرم منفی دارد.
آنژیوادم ارثی یکی از بیماریهایی است که به دلیل جهش در پروتئينهای تنظیمی سیستم کمپلمان ایجاد میشود. در بیماران مبتلا به این بیماری مهارکننده C1 استراز جهش یافته است. در این حالت اثر C1 روی پروتئينهای C4 و C2 کنترل نمیشود و پپتیدهای وازواکتیو زیادی تولید میشود. این پپتیدها نفوذپذیری سلولهای اندوتلیال رگ را افزایش میدهند و منجر به ادم بافتی میشود. نقص پروتئینهای گلیسرول فسفاتیدیل اینوزیتول (GPI) یکی دیگر از بیماریهای ژنتیکی است که فعالیت سیستم کمپلمان را مختل میکند. CD59 و CD55 دو پروتئین متصل به لنگر GPI هستند. این پروتئینها لیز شدن گلبولهای قرمز، لنفوسیتها، گرانولوسیتها، سلولهای اندوتلیال و سلولهای اپیتلیال بهوسیله سیستم کمپلمان را مهار میکنند. جهش این پروتئین منجر به آنمی، تشکیل لختههای خون و عفونتهای مزمن میشود.
نقص ایمنی ثانویه
نقص ایمنی ثانویه در نتیجه ابتلا به بیماریهای دیگر بهوجود میآید. سوتغذیه و استفاده از داروها دو دلیل اصلی نقص ایمنی ثانویه است. داروهای شیمیدرمانی و داروهای سرکوب سشیستم ایمنی در پیوند عضو، با نقص ایمنی ثانویه همراه است.
نقص ایمنی اکتسابی
«نقص ایمنی اکتسابی» (Acquired Immunodeficiency Syndrome | AIDS) بیماری است که به دلیل آلودگی به «ویروس نقص ایمنی انسان» (Human Immunodeficiency Virus | HIV) ایجاد میشود. این ویروس از راه خون، مایع منی، ترشحات واژن و شیر مادر منتقل میشود. HIV رتروویروس پوششدار است. داخل پوشش لیپیدی این ویروس دو RNA تکرشتهای و سه آنزیم اینتگراز پروتئیاز و رونوشتبردار معکوس وجود دارد. پوشش لیپیدی HIV بخشی از غشای سلول میزبان است که گلیکوپروتئینهای ویروسی در آن وجود دارد. این گلیکوپروتئینها به CD4 غشای لنفوسیتهای T، ماکروفاژها و سلولهای دندریتی متصل میشوند. اتصال گلیکوپروتئنها به CD4 سبب تغییر کنفورماسیون گلیکوپروتئینهای غشای ویروس و اتصال آن به کمکگیرندههای سلول هدف میشود. بر اساس نوع گلیکوپروتئین پوشش ویروس، نوع کمکگیرنده متفاوت است.
پس از اتصال مولکولهای سطحی پوشش ویروس با غشای سلول هدف ادغام و ویروس وارد میزبان می شود. یک نسخه cDNA از RNA ویروسی بهوسیله آنزیم رونوشتبردار معکوس تولید میشود. cDNA ممکن است در سیتوپلاسم باقی بماند و پروتئینهای ویروسی از رونویسی آن تولید شود یا ممکن است پس از ورود به هسته با DNA میزبان ادغام شود. به این ترتیب ویروس HIV ممکن است سالها بدون ایجاد علائم در فرد تکثیر و به افراد دیگر منتقل شود. در این وضعیت سلولهای آلوده به ویروس بهوسیله لنفوسیتهای T کشنده از بین میروند، رشد ویروس در سلولها احتمال آپوپتوز سلول را افزایش میدهد و تولید ویروس و آزاد شدن منجر به لیز شدن سلولها میشود. در نتیجه تعداد سلولهای CD4 و پاسخ ایمنی بدن کاهش مییابد.
بیماری های خودایمن
اگر تا این بخش از مطلب ژنتیک ایمنی چیست با ما همراهی کرده باشید، با انواع نقص سیستم ایمنی آشنا شدهاید. در این بخش قصد داریم انواع بیماریهای خودایمنی را بررسی کنیم. در بیماریهای خخودایمنی لنفوسیتهای B و T که در انتخاب منفی و بهوسیله لنفوسیتهای تنظیمکننده از بین نرفتهاند، مولکولهای خودی را آنتیژن شناسایی و علیه آن پاسخ ایمنی ایجاد میکنند. بیماریهای خودایمن برخلاف بیماریهای نقص ایمنی به دلیل جهش در چند ژن ایجاد میشوند. عوامل ژنتیکی، محیطی، هورمونها و مصرف بعضی از داروها احتمال ابتلا به بیماریهای خودایمنی را افزایش میدهد.
انواع بیماری های خودایمنی
در این بخش ابتدا بیماریهای شایعی که به دلیل پاسخ ایمنی آنتیبادی ایجاد میشود و در ادامه بیماریهایی که به دلیل پاسخ ایمنی سلولهای T ایجاد میشود را توضیح میدهیم. آنمی همولیتیک، میاستنی گراویس، بیماری گریوز و لوپوس اریتماتوز (SLE) بیماری هستند که به دلیل اتوآنتیبادیها ایجاد میشوند و تیروئیدیت هاشیموتو، مالتیپل اسکلروزیس (MS)، دیابت نوع I و روماتوئید آرتریت به دلیل فعالیت سلولهای T ایجاد میشود.
آنمی همولیتیک
آنمی همولیتیک به دلیل آنتیبادیهایی ایجاد میشود که به آنتیژنهای گروه خونی را بیگانه شناسایی میکنند. اتصال آنتیبادی به این آنتیژنها با فعال کردن سیستم کمپلمان، افزایش فاگوسیتوز یا تحریک لیز شدن بهوسیله سلولهای کشنده طبیعی، گلبولهای قرمز را از بین میبرد و منجر به کمخونی میشود. بعضی از این باکتریها در دمای معمولی بدن (دمای ۳۷ درجهسانتیگراد) و بعضی از آنها در دمای پایینتر از ۳۷ درجهسانتیگراد به آنتیژنها متصل میشوند. بیشتر آنتیبادیهایی که در دمای طببعی بدن به آنتیژن متصل میشوند از نوع IgG و بیشتر آنتیبادیهایی که در دمای پایین به آنتیژن متصل میشود از نوع IgM است.
میاستنی گراویس
میاستنی گراویس به دلیل آنتیبادیهایی ایجاد میشود که گیرنده استیل کولین در سیناپس عصب-عضله ایجاد میشود. آنتیبادی به جایگاه اتصال استیل کولین در غشای عضله متصل میشود و اتصال استیل کولین و تحریک انقباض عضله را مهار میکند. احتمال ابتلا به این بیماری در زنان بیشتر از مردان است. این بیماری با اللهای HLA-DR3 مرتبط است. ضعف عضلات در میاستنی گراویس منجر به مشکلات جویدن، بلع غذا و تنفس میشود و ممکن است منجر به مرگ بیمار شود.
بیماری گریوز
بیماری گریوز به دلیل آنتیبادیهایی ایجاد میشود که آکونیست هورمونهای محرک تیروئیدی (TSH) است و ترشح هورمونهای تیروئیدی را افزایش میدهد. احتمال ابتلا به این بیماری در زنان ۸ برابر زنان است. در شرایط طبیعی بدن هورمون TSH به گیرندههای غده تیروئید متصل میشود و ترشح هورمونهای تیروئیدی را تحریک میکند. افزایش هورمون تیروئیدی در خون با فیدبک منفی ترشح TSH را کاهش میدهد. در نتیجه ترشح هورمون تیروئیدی کاهش مییابد. اما در میاسنتی گراویس آنتیبادیها پیوسته گیرنده را تحریک میکند و ترشح هورمون تیروئیدی افزایش مییابد.
لوپوس اریتماتوز
در لوپوس اریتماتوز، سیستم ایمنی DNA دورشتهای هسته را آنتیژن شناسایی و علیه آن آنتیبادی تولید میکند. این آنتیبادیها به سلولهای پوست، مفصل، ریه، رگهای خونی، قلب، کلیهها و مغز آسیب میرساند. آنتیبادیهای DNA تکرشته به طور معمول در خون فرد وجود دارد. اما از نوع IgM است که تمایل پایینی به آنتیژن دارد. اما تغییر کلاس آنتیبادی در سلولهای T به کمک سلولهای T منجر به تولید اتوآنتیبادیهای IgG میشود که تمایل زیادی به DNA دورشتهای دارد. در لوپوس اریتماتوز، DNA دورشتهای سیستم ایمنی را حین آپوپتوز فعال میکند. احتمال ایجاد این بیماری در دوقلوهای همسان بیشتر از دوقلوهای غیرهمسان است. این بیماری به دلیل جهش در ژنهای HLA کلاس II ایجاد میشود.
تیروئیدیت هاشیموتو
در تیروئیدیت هاشیموتو، سیستم ایمنی بدن آنزیم تیروئید پروکسیداز و هورمون تایروگلوبین را آنتیژن شناسایی و علیه آن پاسخ ایمنی ایجاد میکند. این بیماری به دلیل اتوآنتیبادیها و فعالیت سلولهای Th1 ایجاد میشود. سیتوکینهای سلولهای Th1 به فعال شدن ماکروفاژها، سلولهای دندریتی و سلولهای B کمک میکند.
مالتیپل اسکلروزیس
در بیماری مالتیپل اسکلروزیس میلین اطراف آکسون نورونهای سیستم عصبی مرکزی از بین میرود. در عفونتهای ویروسی ممکن است نفوذپذیری مویرگهای سد خونی-مغزی و انتگرینهای غشای سلولهای T افزایش یابد و سلولهای T از مویرگهای مغزی عبور کنند. متالوپروتئاز سلولهای T فعال، کلاژنهای غشای پایه مویرگها از بین میبرد و سلولهای T در مغز جمع میشوند. سلولهای Th1 بهوسیله آنتیژنهای خودی تحریک میشوند و سیتوکینهایی ترشح میکنند که ماکروفاژها را فعال میکند. ماکروفاژ فعال سیتوکینهایی ترشح میکند که سبب تجمع نوتروفیلها و ماستوسیتها در مغز و تحریک پاسخ التهابی میشود. سیتوکینهای التهابی بیان Fas در اولیگودندروسیتها را افزایش میدهد. FasL لنفوسیتهای T و سلولهای میرکروگلیا به این پروتئین متصل و اولیگودندروسیتها (سلولهای میلینساز سیستم عصبی مرکزی) آپوپتوز میشوند.
دیابت نوع I
در دیابت نوع I یا دیابت وابسته به انسولین سلولهای بتای پانکراس از بین میروند. کار این سلولها سنتز هورمون انسولین است. این هورمون جذب گلوکز در سلولها را افزایش میدهد. در این بیماری لنفوسیتهای T کشنده، سلولهای بتا را از بین میبرند. جهش ژنهای HLA کلاس II و ژن انسولین روی کروموزوم ۱۱ نقش مهمی در ایجاد این بیماری دارد.
روماتوئید آرتریت
در روماتوئید آرتریت، تجمع لنفوسیتها در غشای مفصلی منجر به ایجاد التهاب و از بین رفتن غضروف و استخوان میشود. در بعضی از مفصلها، تجمع سلولها منجر به تغییر شکل غشای مفصلی و تشگیل فولیکولها اندامهای ثانویه در این بافت میشود. در بیشتر بیماران مبتلا به روماتوئید آرتریت IgM تولید میشود که به جایگاه غیرآنتیزنی IgG متصل میشود. به کمپلکس IgM-IgG فاکتور روماتوئیدی گفته میشود. این کمپلکس در مفصل رسوب و فاکتورهای التهابی را به سمت مفصل هداست میکند. احتمال ابتلا به این بیماری در زنان سه برابر مردان است. اللهای HLA-DR4، ژن فاکتور نکروز تومور آلفا و پروتئینهای شوک حرارتی در ایجاد این بیماری نقش دارند.
معرفی کتاب ژنتیک ایمنی
اگر در بخشهای قبلی مطلب ژنتیک ایمنی چیست را مطالعه کرده باشید، با مفهوم ژنتیک ایمنی، تغییرات ژنتیکی آنتیبادی و گیرندههای لنفوسیت T و بیماریهای ژنتیکی سیستم ایمنی آشنا شدهاید. در این بخش قصد داریم تعدادی از کتابهایی که به یادگیری بهتر ژنتیک ایمنی کمک میکند را معرفی کنیم. لازم به ذکر است که اگر به منابع جامع در مورد مباحث مختلف پزشکی نیاز دارید، مشاهده فیلمهای آموزشی مجموعه آموزش علوم پزشکی فرادرس که لینک آن در ادامه آورده شده است به شما پیشنهاد میشود.

کتاب کلیات مولکولی و بالینی ایمونوژنتیک
کتاب کلیات مولکولی و بالینی ایمونوژنتیک، اصول پایه و جدیدترین مطالب را بالینی ژنتیک ایمنی را به همراه کاربرد بالینی آنها در اختیار خوانندگان میگذارد. نویسنده در فصلهای ابتدایی این کتاب مطالب پایه ژنتیک ایمنی را توضیح میدهد. در ادامه کاربردهای بالینی مطالب پایه را مرور و در انتها چشمانداز آینده ایمونوژنتیک را بررسی میکند. خواننده پس از مطالعه این کتاب با مفهوم ژنتیک ایمنی، انواع مولکولهای MHC و ژنهای HLA و نقش ژنتیک در بیماریهای سیستم ایمنی آشنا میشود.

کتاب روش ها و پروتکل های ایمونوژنتیک
کتاب روشها و پروتکلهای ایمونوژنتیک، روشهای کاربردی برای پژوهش در مورد سیستم ایمنی اکتسابی را معرفی میکند. فصلهای مختلف این کتاب به پروتکلهای آزمایشگاهی و آنالیزهای بیوانفورماتیکی سیستم ایمنی به همراه مثالهای کاربردی اختصاص داده شده است. نویسنده در این کتاب تلاش کرده است، تمام روشهای برپایه سلول، بدون سلول و بدون DNA را در مطالعه ژنتیک ایمنی بررسی کند. هر فصل این کتاب با معرفی روش و لیست مواد مورد نیاز آزمایش شروع میشود و با آموزش گامبهگام پروتکل و روشهای عیبیابی ادامه مییابد. در فصلهای این کتاب در مورد توالییابی نسل جدید برای شناسایی بازآرایی ژن در سلولهای B و T، آنالیز بازآرایی ژن ایمونوگلبولینها و گیرنده سلول T با استفاده از توالی RNA، سلولهای T مهندسی شده برای اهداف درمانی و روشهای مولکولی دیگر میخوانید.

کتاب ایمونوژنتیک
کتاب ایمونوژنتیک در ۱۲ فصل مفاهیم اصلی ژنتیک ایمنی را برای خواننده توضیح میدهد. فصل اول این کتاب به کمپلکس سازگاری بافت اصلی و نقش آن در بیماریهای عفونی و خودایمنی اختصاص داده شده است. فصلهای بعدی این کتاب، ژنتیک ایمونوگلوبولینهای انسان، کلونهای سلول T، ژن کمپلکس سازگاری بافت اصلی موش و تولید، آنالیز و کابرد آنتیبادیهای مونوکلونال موش و انسان را توضیح میدهد. به علاوه در این کتاب بیماریهای ژنتیکی سیستم ایمنی ازجمله روماتوئید آرتریت، لوپوس اریتماتوز، مالتیپل اسکلروزیس و بیماریهای خودایمنی غده تیروئید بررسی شده است.
کتاب ژنتیک ایمنی حمید معدنچی
کتاب ژنتیک ایمنی با بیانی ساده و با استفاده از تصاویر مناسب مفاهیم پایه و کاربردهای ژنتیک ایمنی در تشخیص بیماریها را توضیح میدهد. نویسنده کتاب را یا توضیح کلی سیستم ایمنی، سلولها و مکانیسمهای آن شروع میکند. در ادامه ساختار عملکرد آنتیبادی، ژنتیک آنتیبادی و تکامل لنفوسیتهای B، ساختار و ژنتیک گیرندههای آنتیژنی لنفوسیتهای T، تکامل سلولهای T، مولکولهای MHC، سیستم کمپلمان و گروههای خونی را توضیح میدهد. نویسنده در فصلهای پایانی ژنتیک بیماریهای سیستم ایمنی و نحوه تشخیص و درمان این بیماریها را مرور میکند.

جمعبندی ژنتیک ایمنی
در این مطلب از مجله فرادرس توضیح دادیم که ژنتیک ایمنی ویژگیهای ژنتیکی سیستم ایمنی را بررسی میکند. در ابتدا این مطلب توضیح دادیم که زنجیرههای سبک و سنگین آنتیبادیها بهوسیله ژنهای متفاوت کد میشود. بازآرایی این ژنها در مراحل مختلف تکامل و فعال شدن سلولهای B، دلیل اتصال اختصاصی آنتیبادی به آنتیژنهای مختلف است. به علاوه نوترکیبی ژن با تغییر کلاس آنتیبادی از IgM به IgG یا IgE یا IgA، تمایل آنتیبادی به آنتیژن را تغییر میدهد. در ادامه تغییرات ژنتیکی سلولهای T در مراحل تکامل را بررسی کردیم و متوجه شدیم که نوترکیبی ژن زنجیرههای گیرنده آنتیژنی لنفوسیت T دلیل اتصال اختصاصی این گیرندهها به آنتیژنهای متفاوت است.
در ادامه مطلب توضیح دادیم که کمپلکس سازگاری بافت، پروتئینهای ارائهدهنده آنتیژن هستند که در غشای تمام سلولهای هستهدار بدن وجود دارند و در جریان فعال شدن لنفوسیتها به گلیکوپروتئینهای CD4 یا CD8 متصل میشوند.در بخشهای بعدی توضیح دادیم که بیماریهای نقص سیستم ایمنی و خودایمنی به دلیل جهش در یک یا چند ژن ایجاد میشود و در انتها چهار کتاب ایمونوژنتیک برای معرفی کردیم.
source

