در این مطلب از مجله فرادرس میخواهیم به این سوال بپردازیم که چه عامل یا عواملی موجب «آروماتیسیته» یا همان «ویژگی آروماتیکی» (Antiaromaticity) در گونههای شیمیایی میشود و چگونه میتوانیم این ویژگی را در ترکیبات پیشبینی کنیم؟ به عنوان مثال چرا «بنزن» آروماتیک است اما «سیکلواکتاتتران» آروماتیک نیست؟ اگرچه برخی از مولکولهای آروماتیک (معطر) واقعا معطر هستند، مانند «وانیلین» (Vanillin)، بااینحال اصطلاح «آروماتیک»، الزاما ارتباطی به عطر و بو ندارد. مولکولهایی نیز وجود دارند که با وجود آروماتیک بودن، مانند ساختارهایی امثال «سیکلوکتاتتران» (Cyclooctatetraene) که مشابه نمونه کلاسیک بنزن است، شباهتی به بنزن ندارند. پس قوانین یا الگوهای حاکم چیست؟! خواهیم دید که مولکولهای آروماتیک ویژگیهایی بارز از خود بروز میدهند و از چهار قانون مشخص عبور میکنند که یادگیری این قوانین و اشراف بر نحوه به کارگیری پله به پله آنها، تشخیص ترکیبات آروماتیکِ قانونمند را از غیرآروماتیک ممکن میکند.

قوانین آروماتیک چیست؟
در مقالههای پیشین در رابطه با مفهوم «آروماتیک» در برخی مولکولهای آلی با پایداری خارج از حد انتظار، مانند بنزن و علل ایجاد این پایداری صحبت کردیم و هیدروکربنهای آروماتیک را نیز به طور کامل معرفی کردیم. حال در این مقاله قصد داریم با دقتنظر بالاتری مولکولها را از منظر مبانی آروماتیسیته مورد تحلیل قرار دهیم. اشاره کردیم که قوانینی در این زمینه وجود دارد، قوانینی که با بهرهگیری از آنها، علت آروماتیک بودن یا نبودن ساختارهایی ازجمله نمونههای آمده در تصویر زیر آشکار میشود.
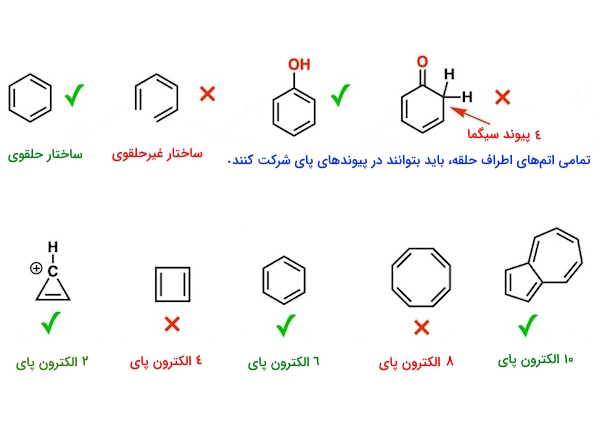
چهار قانون کلیدی در مولکول های آروماتیک چیست؟
تا اینجا یاد گرفتیم که آروماتیک چیست اما برای اینکه مولکول یا ترکیبی آروماتیک باشد، لازم است ۴ شرط پیشِ رو به طور کامل در آنها برقرار باشد. توجه کنیم که این شروط اصطلاحا همه یا هیچ است، یعنی با همبودن آنها، تعیینکننده ویژگی آروماتیک بوده و در صورت نقض هر یک، مولکول مورد بررسی از دایره ترکیبات آروماتیک خارج خواهد بود. این چهار شرط را باید بررسی کنیم تا بدانیم آروماتیک چیست و چه قوانینی دارد.
- باید دارای ساختار «حلقوی یا چرخهای» (Cyclic) باشد که در ادامه مقاله با عنوان حلقوی به این مورد اشاره خواهیم کرد.
- هر اتم در حلقه باید «مزدوج» (Conjugated) باشد.
- مولکول باید دارای $$۴n+۲$$ الکترون پای ($$pi$$) (π-electron) باشد.
- مولکول باید «مسطح» (Flat) باشد. (معمولاًًًً – و نه الزاما همیشه – در صورت برقراری شرایط یک تا سه، این شرط هم برقرار میشود).
در ادامه با جزئیات بیشتری به طرح و شرح این قوانینِ به وجودآورنده خصلت آروماتیسیته و چگونگی کاربرد آنها میپردازیم.
قانون اول: مولکول ساختار حلقوی داشته باشد
قانون نخست و شرط شماره یک برای آروماتیک بودن یک گونه شیمیایی، داشتن ساختار حلقوی است.
این قانون بسیار ساده و در ساختار ترسیمی مولکول قابل رویت و تشخیص است که در صورت برقراری آن، به سراغ بررسی ادامه قانونها میرویم، ولی توجه کنیم که اگر این شرط برقرار نباشد، یعنی مولکول مدنظر ساختار حلقوی نداشته باشد، بررسیها را ادامه نداده و مولکول آروماتیک نخواهد بود.
مثال: مولکول ۱، ۳، ۵-هگزاترین که در تصویر پایین نمایش داده شده است، دارای تعداد «پیوند پای» و «الکترون پای» یکسانی با بنزن است، اما آروماتیک نیست، چون ساختار غیرحلقوی دارد و متوجه شدیم که ساختار غیرحلقوی برابر با غیرآروماتیک است.
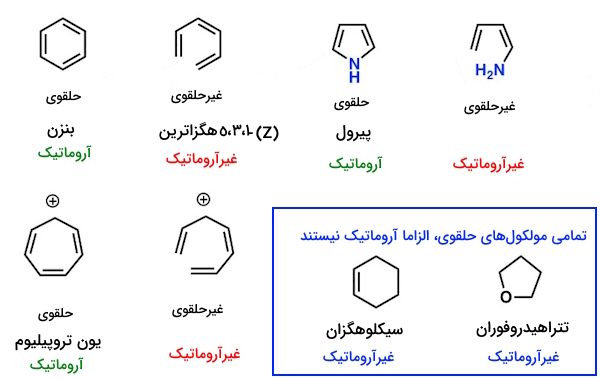
نکته: توجه به این نکته ضروری است که اگر چنانچه ساختاری غیرحلقوی باشد، به طور مشخص، آروماتیک نیست، ولی هر ساختار حلقوی نیز الزاما آروماتیک نبوده و برای اظهارنظر قطعی، لازم است به بررسی سایر قوانین آروماتیسیته در آن بپردازیم، به سخنِ دیگر، حلقوی بودن ساختار، شرط لازم برای برقراری آروماتیسیته است، ولی شرط کافی نیست.
قانون دوم: هر اتم در حلقه باید مزدوج باشد
گفتیم که حلقوی بودن شرط لازم برای آروماتیک بودن است، ولی شرط کافی نیست، مانند سیکلوهگزان، در تصویر بالا داخل کادر، که با وجود داشتن ساختار حلقوی، آروماتیک نیست. برای داشتن این ویژگی، لازم داریم حلقوی پیوسته از اوربیتالهای پی ($$p$$) در اطراف حلقه وجود داشته باشند که تشکیل حلقوی بزرگتر، با نام «سیستم پای» را میدهند، یعنی هر اتم در اطراف حلقه، باید قابلیت پیوند «مزدوج» با یکدیگر را داشته باشد.
سایر تعریفهای قانون هوکل
قانون دوم هوکل، شرط مزدوج بودن اتمهای حلقه را میتوانیم به روشهای دیگر نیز بیان کنیم که تمامی تعریفها از این قانون، یک معنای واحد را منتقل میکنند ازجمله:
- هر اتم حلقه، یعنی تمامی اتمهای اطراف حلقه، باید دارای اوربیتال پی باشد، یا
- تمامی اتمهای اطراف حلقه، باید بتوانند از طریق رزونانس در پیوند پای شرکت کنند.
به یاد داشته باشیم که شرط «وجود اوربیتال $$p$$»، نه فقط برای اتمهایی که بخشی از پیوند «پای» ($$pi$$) هستند، بلکه برای سایر اتمهایی که دارای «یک جفت الکترونغیرپیوندی»، «رادیکال» یا «اوربیتال $$p$$ خالی» هستند، مانند «کربوکاتیونها» (Carbocations)، نیز اعمال میشود، یعنی اتمهای دارای ویژگیهای مذکور (دارای پیوند پای، دارای جفتالکترون غیرپیوندی، رادیکالها و کربوکاتیونها)، میتوانند در رزونانس شرکت کنند، اتمهای فاقد این ویژگیها نمیتوانند.
نکته مهم: یک اتم هیبریدشده $$sp^{۳}$$، با چهار پیوند متصل به آن، میتواند در رزونانس شرکت کند.
به طور کلی «مزدوج شدن» (Conjugation)، را برای پدیدهای به کار میگیریم که در آن الکترونهای پای (الکترونهای داخل اوربیتالهای پی)، میتوانند در بیش از سه اتم به اشتراک گذاشته شوند. اکنون میخواهیم با آوردن مثالهایی، به بررسی این قانون و موارد پیرامونِ آن بپردازیم.
مثال: در این مثال مولکولهای «دیان» (Diene) مزدوج و غیرمزدوج را بررسی میکنیم. دیانها، گونهای از هیدروکربنها در شیمی آلی با دو پیوند دوگانه بین اتمهای کربن هستند. میخواهیم ببینیم کدامیک از این دو مولکول مزدوج است؟!
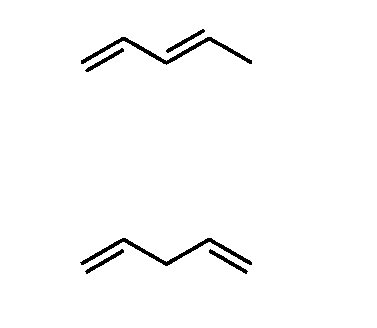
- مولکول ابتدایی، دارای پیوندهای دوگانه متوالی است که به آن دیان مزدوج (Conjugated Dienes) میگوییم.
- مولکول دوم، پیوندهای دوگانه متوالی ندارد، درنتیجه دیان غیرمزدوج (Non-Conjugated Dienes) است.
مثال: میخواهیم بررسی کنیم که کدامیک از موارد تصویر زیر مزدوج و کدامیک غیرمزدوج است.
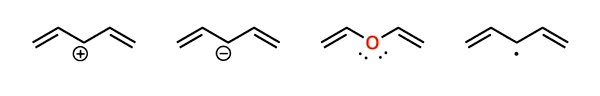
ممکن است در نگاه اول این مولکولها مزدوج به نظر نرسند، درحالیکه مزدوج هستند! در واقع ما نیازمند اتمهایی هستیم که بتوانند در رزونانس شرکت کنند. این امر میتواند حداقل در چهار مورد روی بدهد، ازجمله:
- کربن یا سایر اتمها با اوربیتال خالی پی مانند: کربوکاتیون.
- کربن با اوربیتالهای نیمهپر پی مانند: رادیکال،
- کربن با جفت غیرپیوندی مانند: «کربانیون» (Carbanion)،
- هرگونه اتم دیگری با جفت غیرپیوندی مانند: $$S$$، $$O$$، $$N$$ و… .
برای داشتن تصویری بهتر، فرم رزونانس هریک از موارد مثال بالا را رسم میکنیم.
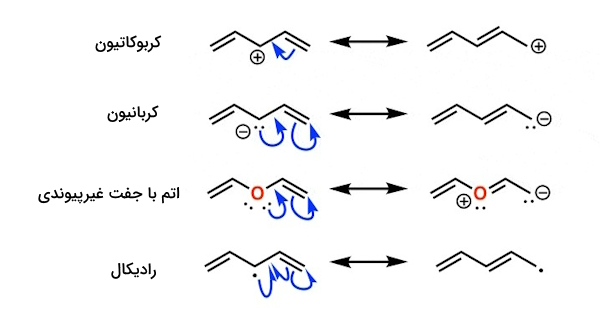
در تصاویر میبینیم که اتم میانی در پیوند پای شرکت میکند. این امر نشان میدهد که الکترونها میتوانند بین اتم مرکزی و آلکنهای کناری به اشتراک گذاشته شوند، درنتیجه کل سیستم مزدوج میشود.
مثال: در این مثال قصد داریم دیانهای تصویر زیر را ارزیابی کنیم.
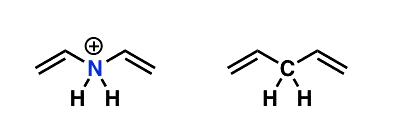
هیچیک از آلکنهای این مثال مزدوج نیستند.
یادآوری: اگر اتم بین دو پیوند پای، دارای جفت غیرپیوندی، اوربیتال پی خالی، یا رادیکال بود، میتوانست در «مزدوج شدن» شرکت کند، اما اگر با چهار اتم پیوند برقرار کرده باشد، نمیتواند در این فرآیند شرکت کرده و مزدوج باشد.
مثال: در مثال زیر میتوانیم موارد آموختهشده را بررسی کنیم.
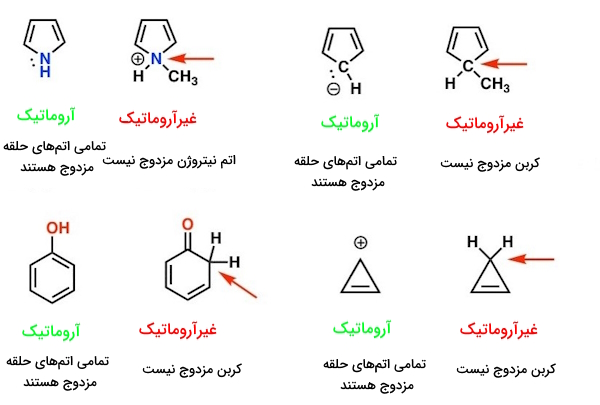
یادآوری: عدم مزدوج شدن در اطراف حلقه شده = نقض شرط دوم = منتفیبودن ویژگی آروماتیک
یادآوری: مزدوج شدن در اطراف حلقه، الزاما به معنای ویژگی آروماتیک نیست و بررسی سایر شرایط آروماتیک، ضروری بپردازیم.
قانون سوم (قانون هوکل): مولکول باید دارای ۴n+۲ الکترون پای باشد
شرط سوم این است که مولکولی که حائز دو شرط بالا است، دارای تعدادی تعریفشده، $$۴n+۲$$ ($$n$$ نماینده اعداد حسابی) از الکترونهای پای باشد.
این قانون در سال ۱۹۳۱ توسط «اریش هوکل» (Erich Hückel)، دانشمند آلمانی، پیشنهاد شد که به اعداد منطبق با این فرمول، اعداد «سری جادویی» (Magic Series) و پس از آقای هوکل، به یاد ایشان، «اعداد هوکل» (Hückel Numbers) نیز گفته میشود. پس روش کار به این صورت است که اگر مقدار الکترون پای محاسبهشده در ترکیب مورد بررسیِ، با هر عددی در این سری، مطابقت داشته باشد، احتمال آروماتیک بودن ترکیب هست و برای اظهارنظر قطعی، لازم است به بررسی سایر شروط ادامه دهیم.
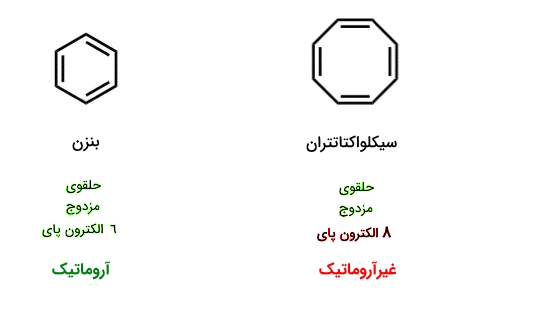
در اینجا پاسخ مثالی که پیشتر در خصوص بنزن و سیکلواکتاتتران مطرح شد، آشکار میشود. گفتیم با اینکه هر دو حلقوی و مزدوج هستند، اما بنزن آروماتیک است ولی سیکلواکتاتتران نیست، چون پس از بررسی و عبور از شرایط اول و دوم، به شرط سوم میرسیم، حال:
- بنزن دارای ۶ الکترون پای است که منطبق بر فرمول $$۴n+۲$$ است، یعنی با در نظر گرفتن مقدار صحیح و مجاز ۱ برای $$n$$، میتوانیم به عدد ۶ برسیم، پس شرط سوم برقرار است. بااینحال هنوز هم نمیتوانیم به رد یا تایید آروماتیک بودن برسیم و لازم است به تطبیق ادامه شروط بپردازیم که آنها نیز در بنزن برقرار بوده و درنتیجه آروماتیک بودن بنزن تایید میشود.
- سیکلواکتاتتران دارای ۸ الکترون پای است که منطبق بر فرمول $$۴n+۲$$ نیست، یعنی ما هیچ مقدار مجازی در حیطه اعداد حسابی نمیتوانیم برای $$n$$ لحاظ کنیم که خروجی ۸ را به ما بدهد، درنتیجه شرط سوم برای آروماتیک بودن نقض شده و سیکلواکتاتتران از رده ترکیبات آروماتیک خارج میشود.
سوالات و ابهامات احتمالی در مورد قانون سوم هوکل
مواجهه نخست با این قانون ممکن است از جهاتی ابهامآفرین باشد، به عنوان مثال عبارت $$۴n+۲$$، گاهی موجب سردرگمی میشود که بهسبب پیشگیری از خطاهای احتمالی، پرداخت بیشتری در قالب سوال و پاسخ به آن داریم.
$$۴n+۲$$ در قانون سوم هوکل به چه معناست؟
$$۴n+۲$$ فرمولی است که به ما می گوید چه اعدادی در سری جادویی یا سری هوکل قرار میگیرند. در واقع مقادیری را که در صورت برابری مقدار الکترونهای پای با آنها، احتمال آروماتیک بودن مولکول فراهم میشود، فرموله کرده و به فرمول $$۴n+۲$$ رسیدهایم، حال اگر مقدار الکترون پای در ترکیب مورد بررسی ما، مطابق اعداد مجاز در این سری باشد، به این معنی است که مولکول مد نظر ما میتواند آروماتیک باشد و به سراغ بررسی شرط چهارم میرویم و اگر نه، آروماتیک بودن منتفی میشود.
عبارت ۴n+۲ به چه معناست؟
سوال دیگری که ممکن است ایجاد شود، این است که: گفته میشود لازم است یک مولکول ۴n+۲ الکترون پای داشته باشد تا آروماتیک باشد. خب حال چگونه «$$n$$» را پیدا کنیم؟
در قانون هوکل، فرمول $$۴n+۲$$ عبارت جبری سری ۲، ۶، ۱۰، ۱۴ و… است، در شرایطی که $$n$$ در این فرمول، یک عدد حسابی باشد. یعنی از نظر جبری، میتوانیم مقادیر سری بالا را با فرمول $$۴n +۲$$، فرموله کنیم، ولی لازم است برای $$n$$ هم چارچوبی تعریف کنیم که این چارچوب مجاز برای آن، اعداد حسابی (اعداد طبیعی به اضافه صفر) است (۰، ۱، ۲، ۳ و …).
اگر در فرمول $$۴n +۲$$، اعداد حسابی را جایگزین کنیم، به ترتیب خروجیهای زیر حاصل میشود:
- برای $$n=۰$$ خواهیم داشت: $$(۴times۰)+۲=۲$$
- برای $$n=۱$$ خواهیم داشت: $$(۴times۱)+۲=۶$$
- برای $$n=۲$$ خواهیم داشت: $$(۴times۲)+۲=۱۰$$
- برای $$n=۳$$ خواهیم داشت: $$(۴times۳)+۲=۱۴$$
- برای $$n=۴$$ خواهیم داشت: $$(۴times۴)+۲=۱۸$$
و به همین ترتیب برای سایر مقادیر $$n$$ در حیطه اعداد حسابی که ارتباطی به ترکیب ما ندارد، مقادیر $$۴n+۲$$ نمایان میشود، یعنی با استفاده از فرمول $$۴n +۲$$ در محدوده $$n$$ تعریفشده، به سری اعداد ۲، ۶، ۱۰، ۱۴، ۱۸… و … یا همان سری هوکل میرسیم.
نکته مهم: قانون هوکل در تعداد الکترونهای پای بالاتر (بیش از ۲۰) در «سیستمهای چندحلقوی» (Polycyclic Systems) شروع به خارج شدن از قاعده خود میکند، پس این قانون را در تعداد الکترونهای پای کمتر از ۲۰ به کار میگیریم.
راهحل دیگرِ استفاده از قانون هوکل
میتوانیم پس از شمارش و مشخص کردن تعداد الکترونهای پای، رابطه $$۴n +۲$$ را با آن مساوی قرار داده و $$n$$ را بیابیم، اگر چنانچه مقدار $$n$$، عددی از اعداد حسابی شد، یعنی مولکول ما آروماتیک است و بالعکس، به عنوان مثال، در بنزن ۶ الکترون پای داریم که با مساوی قرار دادن رابطه $$۴n +۲$$ با ۶، به عدد ۱ برای $$n$$ میرسیم که جزو اعداد حسابی است، پس قانون سوم در آن برقرار میشود. پیشنهاد میشود این موارد را به دفعات متعدد و در مثالهای متنوع مورد ارزیابی دقیق قرار دهیم تا در ذهن تثبیت شود.
جمعبندی نکات مهم این قسمت
- «$$n$$» از ویژگیهای مولکول یا مشخصه مولکول نیست.
- «$$n$$» از جبر میآید، نه از شیمی و به دنبال آن در مولکول نباشیم.
- «$$n$$» نشاندهنده اعداد حسابی است.
- این شرایط که مولکولهای آروماتیک باید دارای $$۴n+۲$$ الکترون پای باشند، گاهی اوقات «قانون هوکل» (Hückel’s Rule) نامیده میشود.
- میتوانیم مولکولهای آروماتیکی با ۲، ۶، ۱۸ و… الکترون پای پیدا کنیم، اما هرگز مولکولهای آروماتیکی با تعداد الکترونهای پای ۰، ۱، ۴، ۵، ۱۱، ۱۷ و …پیدا نخواهیم کرد، چرا که این اعداد در قاعده هوکل قرار نمیگیرند.
- قرارگیری تعداد الکترونهای پای در فرمول $$۴n+۲$$، از شروط لازم برای آروماتیک بودن هست ولی کافی نیست، چرا که لازم است تمامی شروط پوشش داده شود و برای این امر به سراغ بررسی ادامه قوانین میرویم.
- ممکن است ساختارهایی داشته باشیم با تعداد الکترون پای منطبق با فرمول و سری هوکل ولی غیرآروماتیک، چون سایر شروط در آنها برقرار نیست.
در شکل زیر، تعداد الکترونهای مولکولهایی که واجد شرایط قانون هوکل میشوند، سبز رنگ و آنهایی که قانون هوکل را پوشش نمیدهند، با رنگ قرمز درج شدهاند.
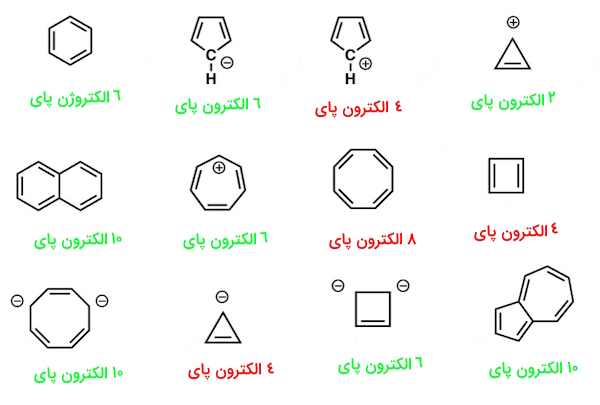
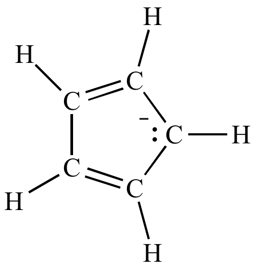
توجه کنیم که میتوانیم الکترونها را در پیوندهای پای و همچنین الکترونهای جفتهای غیرپیوندی را بشماریم (مادامیکه کربن از قبل در پیوند پای شرکت نکرده باشد – در قسمت پایین بیشتر توضیح میدهیم)، بنابراین «آنیون سیکلوپنتادین» (Cyclopentadiene Anion) در تصویر زیر، دارای شش الکترون پای است – چهار الکترون از دو پیوند دوگانه و دو الکترون از جفت غیرپیوندی روی کربن.
کدام الکترونها، «الکترون پای» هستند؟
در شمارش تعداد الکترونهای پای، چگونه عمل میکنیم؟ تشخیص اینکه کدام الکترونها به عنوان الکترون پای به حساب میآیند و کدامها نه! چگونه است؟! زمانیکه اتمهایی در حلقه داشته باشیم که هم در پیوند پای شرکت کرده و هم یک جفت غیرپیوندی داشته باشند، ممکن است شبهه ایجاد شود، برای مثال در ساختارهای زیر:
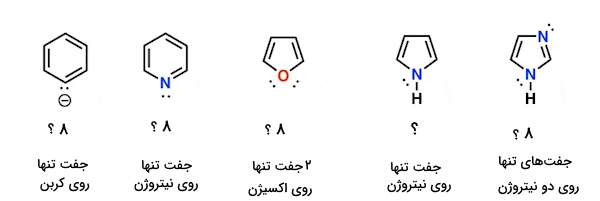
- چگونه الکترونهای موجود در آنیونِ بنزن (تصویر بالا سمت چپ) یا «پیریدین» (Pyridine) را بشماریم؟ آیا باید الکترونهای جفت غیرپیوندی را به عنوان الکترونهای پای حساب کنیم که در مجموع میشود ۸؟ یا اینکه آنها را نادیده بگیریم؟
- در مورد «فوران» (Furan) (ترکیب وسط) که دو جفت غیرپیوندی روی اکسیژن دارد چطور؟
- در مورد «پیرول» (Pyrrole)، که جفت غیرپیوندی آن روی نیتروژن است، یا «ایمیدازول» (Imidazole)، با دو نیتروژن چطور؟
این مورد را در قالب دو پاسخ سریع و مبسوط شرح میدهیم و پیشنهاد میشود به موازات یادگیری، با مثالهای تصویری آورده شده، مطابقت داده شوند.
پاسخ سریع: در حالت کلی، تمامی الکترونهای عمود بر حلقه، جزو سیستم پای بوده و الکترون پای محسوب میشوند. هر پیوند دوگانه دارای دو الکترون پای است، برای مثال اگر ساختاری دارای دو پیوند دوگانه باشد، چهار الکترون پای از این طریق خواهد داشت. اگر ساختار دارای جفتهای الکترونی باشد، جفتهای عمود بر حلقه را نیز در قالب دو الکترون به حساب میآوریم، یعنی هر جفتالکترون معادل دو الکترون و مجموع تمامی الکترونهای پای را در ساختار برآورد میکنیم.
پاسخ تفصیلی: برای پاسخ عمیقتر بهاین نوع سوالات، یادآوری میکنیم که چگونه اوربیتالهای پی در آروماتیک بودن بنزن همکاری و مشارکت دارند. در بنزن، همانطورکه در تصویر نیز نشان داده میشود، هر اوربیتال $$p$$ با زاویه ۹۰ درجه نسبت به صفحه حلقه قرار گرفتهاست.
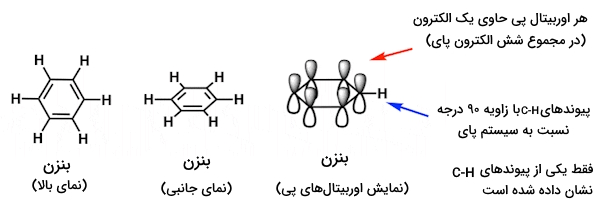
توجه داشته باشیم که پیوندهای $$C – H$$ با زاویه ۹۰ درجه نسبت به سیستم پای قرار دارند. اگر یک جفت غیرپیوندی در جاییکه پیوند $$C – H$$ در آن قرار دارد، قرار بگیرد، تحت هیچ شرایطی قادر به تعامل با سیستم پای نخواهد بود.
الکترونهایی که جزو الکترونهای پای به حساب نمیآید
برخی از الکترونها به عنوان الکترون پای به حساب نمیآید، مانند برخی الکترونها در پیریدین و آنیون بنزن. در آنیون بنزن، مانند تصویر زیر، یک جفت غیرپیوندی روی یکی از کربنها دارد. این جفت نمیتواند در یک اوربیتال $$p$$ قرار داشته باشد، چون اوربیتال $$p$$ در سیستم پای شرکت میکند. به جای آن، با زاویه ۹۰ درجه نسبت به سیستم پای و در صفحه حلقه قرار دارد و به موقعیت جفتالکترون و اوربیتالهای پی در تصویر توجه شود. در واقع جفت غیرپیوندی روی کربن، به عنوان جفتالکترونهای پای به حساب نمیآید، زیرا قادر به همپوشانی با سیستم پای نخواهد بود.

در مورد پیریدین، جایی که جفت غیرپیوندی در زاویههای قائمه با سیستم پای قرار دارد نیز همین روال برقرار است. در هر یک از این موارد ممکن است تصور کنیم ۸ الکترون پای وجود دارد، درحالیکه تنها ۶ الکترون پای وجود دارد. ۶ جزو اعداد هوکل است، پس هر دوی این مولکولها بعد از برقراری سایر شروط، میتوانند در دسته ترکیبات آروماتیک قرار بگیرند.
نکته پایانی: هر «اتم حلقه» (Ring Atom)، قادر است حداکثر الکترون پایِ یک اوربیتال $$p$$ را به سمت سیستم پای ببرد.
نمونههایی از حلقههای ۵ عضوی آروماتیک
چند مولکول با حلقههای پنج عضوی را در قالب مثالهایی ارزیابی میکنیم.
مثال: «آنیون سیکلوپنتادین» (The Cyclopentadiene Anion) را بار دیگر و از زاویهای دیگر مورد بررسی قرار میدهیم. این آنیون دارای یک جفت غیرپیوندی روی یکی از کربنها است. آیا این جفت غیرپیوندی میتواند در سیستم پای مشارکت داشته باشد یا نه؟

از آنجا که این کربن در هیچکدام از پیوندهای پای مشارکت ندارد، پاسخ مثبت است. تعداد کل الکترونهای پای برای این آنیون برابر است با ۲ الکترون از جفت غیرپیوندی، به اضافه ۴ الکترون در دو پیوندِ پای که در مجموع ۶ الکترون میشود. این عدد، یک عدد هوکل است، پس میگوییم آنیون سیکلوپنتادین میتواند درصورت پوشش سایر شروط، آروماتیک باشد.
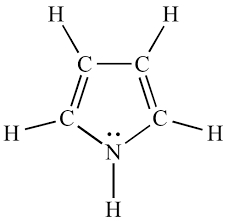
مثال: مولکول بعدی که مورد بررسی قرار میدهیم، «پیرول» (Pyrrole) است که وضعیت به ظاهر مشابهی با مثال بالا دارد. در اینجا نیتروژن دارای یک جفت غیرپیوندی است، اما در پیوند $$pi$$ مشارکتی ندارد، بنابراین میتواند با سیستم پای همکاری کند و در مجموع ۶ الکترون پای به ما میدهد – ۴ الکترون از دو پیوند پای به اضافه دو الکترون از جفت غیرپیوندی.
مثال: یک مورد خاص در این راستا، فوران است که در آن اکسیژن دارای دو جفت غیرپیوندی است. حال سوال این است که آیا فوران دارای ۸ الکترون پای است؟ پاسخ منفی است!
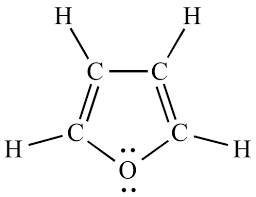
همانطورکه در قسمت بالا اشاره کردیم، هر اتم میتواند حداکثر یک اوربیتال $$p$$ را به سمت سیستم پای هدایت کند. حال در فوران، یک جفت غیرپیوندی در یک اوربیتال $$p$$ وجود دارد که در سیستم پای مشارکت میکند و دیگری در صفحه حلقه قرار دارد، تصویر پایین. پس در مجموع ۶ الکترون پای خواهیم داشت و چون جزو اعداد هوکل است، فوران نیز در صورت پوششدهی کامل سایر شروط، میتواند آروماتیک باشد.
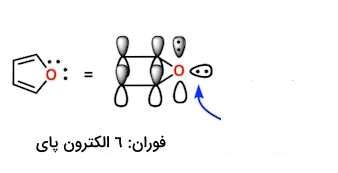
در تصویر بالا:
- اکسیژن که با رنگ قرمز نشان داده شده است، دارای دو جفتتنها است، اما فقط یکی از آنها میتواند بخشی از سیستم پای باشد.
- وقتی جفتالکترون دیگر، شامل دو الکترون، از طریق پیوند پای به سیستم پای اضافه میشوندف در مجموع شش الکترون پای خواهیم داشت.
- جفتتنها با زاویه ۹۰ درجه نسبت به سیستم پای که با فلش آبیرنگ نشان داده میشود، جزو الکترونهای پای محسوب نمیشود.
یادآوری: به اتمی غیر از کربن و اکسیژن در حلقههایی مانند مثالهای بالا، فوران ($$C_{۴}H_{۵}N$$)، پیرول ($$C_{۴}H_{۴}O$$) و … «هتروترم» (Heteroatom) گفته میشود.
مثال: در نهایت به ایمیدازول میرسیم که در ساختار خود دارای دو نیتروژن است. یکی از نیتروژنها ($$N-H$$) در پیوند پای مشارکت ندارد و دیگری که در صفحه حلقه قرار دارد، در این پیوند شرکت میکند. پس در مجموع ۶ الکترون پای خواهیم داشت که جزو اعداد سری هوکل بوده و این مولکول نیز از قاعده هوکل عبور کرده و در صورت پوششدهی سایر شروط، میتواند آروماتیک باشد.
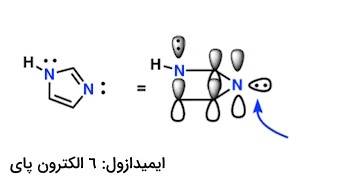
در تصویر بالا:
- نیتروژنی که جزئی از پیوندهای پای نیست، میتواند جفتالکترون خود را اهدا کند.
- جفتتنها با زاویه ۹۰ درجه که با فلش آبیرنگ نشان داده شده است، به عنوان الکترونهای پای محسوب نمیشوند.
قانون چهارم: مولکول باید مسطح باشد
شرط چهارم برای آروماتیک بودن این است که مولکول «صاف یا مسطح» (Flat،Planar) باشد. با مثالی جالب در این مورد شروع میکنیم. مولکول «۱،۳،۵،۷-سیکلواکتاتتران» (۱,۳,۵,۷-cyclooctatetraene)، که گاهی برای سادگی به آن سیکلواکتاتتران گفته میشود، با فرمول شیمیایی $$C_{۸}H_{۸}$$ را که در تصویر نشان داده شده است در نظر میگیریم.
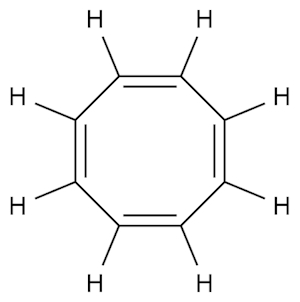
در نگاه اول، به نظر میرسد که ساختاری شبیه بنزن است با حلقوی بزرگتر، رفتار شیمیایی آن نیز همان چیزی است که از یک آلکن انتظار داریم، اما این مولکول بر خلاف بنزن، آروماتیک نیست و شکل آن هم مسطح نیست. البته پیشتر نیز در مطلب کاملی راجع به آلکنها صحبت کردهایم.

میبینیم که این مولکول «قایقیشکل» (Tub-Shaped) است و حالت مسطح ندارد و این شرط هم در آن، علاوه بر قانون هوکل، نقض میشود. سیکلواکتاتتران میتواند به نسبت آسان، دو الکترون به دست آورده و تبدیل به «دیآنیون سیکلواکتاتتران» (Cyclooctatetraene Dianion) ($$C_{8}H_8^{۲-}$$، $$COT^{۲-}$$) شود که مسطح و آروماتیک است. در تصاویر زیر، دو مدل برای نمایش این یون آورده شده است.

و در مدل سهبعدی نشان بدهیم خواهیم داشت:

یون مذکور، علاوه بر برآورد شروط قبلی ازجمله قانون هوکل، شرط آخر را هم پوشش داده و آروماتیک است.
در حالت کلی از مولکولی دارای ویژگیهای:
- چرخهای،
- مزدوج،
- دارای $$۴n+۲$$ الکترون پای،
انتظار مسطحبودن هست و تنها چیزی که میتواند مانع از صافبودن آن شود، این است که تحت فشاری غیرعادی باشد. از نمونههایی در این راستا، میتوانیم به مولکول «سیکلودکاپنتان» (Cyclodecapentaene) یا همان «۱۰-آنولن» (۱۰Annulene) با فرمول شیمیایی $$C_{۱۰}H_{۱۰}$$ اشاره کنیم که ایزومر آن در تصویر زیر، سمت چپ رسم شده است.
نکته: آروماتیسیته خاصیتی با قدرت پایدارکنندگی بسیار بالا استِ، با ارزش ۳۶-۲۰ کیلو کالری بر مول.

در این ایزومرها، مولکول حلقوی، مزدوج و دارای ده الکترون پای است. پس تا اینجای کار سه شرط لازم جهت برقراری خاصیت آروماتیک را دارد، اما وقتی به شرط چهارم میرسیم: دو هیدروژن علامتگذاری شده هنگام تلاش برای ایجاد یک ترکیب مسطح با یکدیگر برخورد میکنند و از مسطح بودن ساختار جلوگیری میشود، درنتیجه شرط چهارم نقض شده و این مولکول آروماتیک نخواهد بود.
به طرز جالبی، اگر هیدروژنها حذف و با یک گروه $$CH_{۲}$$ جایگزین شوند، فشار آزاد شده و پیوندهای $$pi$$ میتوانند حالت یک ترکیب مسطح را به خود بگیرند، مانند مولکول سمت راست در تصویر بالا، که با پوشش شرط آخر، خواص مورد انتظار از یک مولکول آروماتیک را نشان خواهد داد.
- نام «آنولن» (Annulene) در حالت کلی برای مولکولهای حلقوی، دارای پیوندهای متناوب ساده و دوگانه به کار برده میشود. پیشوند عددی نیز نشاندهنده اندازه حلقه است. اکنون میتوانیم بار دیگر از این زاویه، به تصویر مولکول ۱۰-آنولن در بالا نگاهی داشته باشیم. به همین ترتیب بنزن را میتوان به عنوان «۶-آنولن» و سیکلواکتاتتران به عنوان «۸-آنولن» در نظر گرفت.
- همه حلقهها دارای فرمول کلی $$C_{x}H_{x}$$ هستند که $$x$$ در فرمول، نماینده اعداد زوج است و این عبارت به خودی خود الزاما به معنای داشتن ویژگی آروماتیک نیست.
پیادهسازی قوانین آروماتیسیته در ترکیبات مختلف
در این قسمت میخواهیم برای تفهیم بهتر و بیشتر، قوانین تشریح شده در طول مقاله را در قالب مثالهایی شامل مولکولهای خنثی و یونهای مختلفِ در تصویر زیر بررسی کرده و به تحلیل یک به یک آنها از منظر آروماتیسیته بپردازیم. برای این منظور، از رسم جدول استفاده خواهیم کرد. جدول، به عنوان راهکاری مناسب در انسجام دادههای مسئله و نیز به عنوان چکلیست عمل کرده و فرایند ارزیابی و نتیجهگیری را تسهیل میکنند.
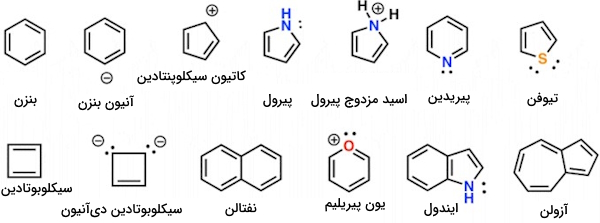
بنزن
سادهترین مثال برای شروع، بنزن است که نحوه استفاده از جدول را نیز با این مثال نشان میدهیم. در ابتدا جدولی شامل ستونهای زیر ترسیم میکنیم. به عناوین ستونها توجه شود. اکنون با در نظر گرفتن ساختار بنزن میبینیم که این مولکول:
- چرخهای،
- مزدوج،
- دارای ۳ پیوند پای است که همگی آنها در سیستم پای مشارکت دارند. هیچ جفت غیرپیوندیی ندارد که در آروماتیک بودن ترکیب همراهی کند، پس در مجموع دارای $$(۲times۳)+۰=۶$$ الکترون پای است،
- مسطح است.

پس با تکمیل سلولهای جدول ترسیمی با اطلاعات به دست آمده، به نتیجه میرسیم که بنزن آروماتیک است.
آنیونِ بنزن
آنیون بنزن با جداسازی یک پروتون از بنزن به دست میآید. مانند بنزن، حلقوی و مزدوج , دارای ۳ پیوند پای است.
نکته مهم: آیا جفت غیرپیوندی در سیستم پای نقش دارد؟ آیا در مجموع ۸ الکترون پای خواهیم داشت یا نه؟ در پاسخ باید بگوییم که این جفت غیرپیوندی در صفحه مولکول قرار دارد، به همراه سایر پیوندهای $$C – H$$، و نمیتواند با اوربیتالهای $$p$$ همپوشانی داشته باشد، بنابراین در تعیین آروماتیک بودن، از این الکترونها چشمپوشی میکنیم.

کاتیون سیکلوپنتادین
«کاتیون سیکلوپنتادین» (The Cyclopentadiene Cation) حلقوی و مزدوج است (بار مثبت نشاندهنده کربوکاتیون با اوربیتال $$p$$ خالی است). دو پیوند پای داریم و جفت غیرپیوندی برای همکاری در سیستم پای وجود ندارد، پس در مجموع ۴ الکترون پای به دست میآید که عدد هوکل نیست و این یعنی نقض یکی از شروط آروماتیسیته نقض آروماتیک بودن ترکیب.

پیرول
پیرول، حلقوی و مزدوج است (جفت غیرپیوندی روی نیتروژن، میتواند در سیستم پای همکاری داشته باشد). دو پیوند پای و یک جفت تکالکترون وجود دارد که در سیستم پای مشارکت دارد، پس در مجموع ۶ الکترون پای داریم که جزو اعداد هوکل است، یعنی با $$۴n+۲$$ مطابقت داشته و نتیجه حاصل میشود که پیرول آروماتیک است.

پیریدین
پیریدین، حلقوی و مزدوج و دارای سه پیوند پای است. این ترکیب شباهت بالایی با آنیون بنزن دارد، چون به نظر میآید که جفت غیرپیوندی ممکن است در سیستم پای مشارکت کند، اما در واقع به همراه پیوندهای $$C – H$$ در صفحه حلقه قرار دارد، بنابراین نمیتواند در این سیستم مشارکتی داشته باشد. نیتروژن که در اوربیتال $$p$$ به سمت سیستم پای است، به صورت مشارکت در یک پیوند دوگانه با کربن مجاور ترسیم شده است، بنابراین میتوانیم جفت غیرپیوندی را برای آروماتیک بودن نادیده بگیریم. در مجموع به شش الکترون پای میرسیم که عدد هوکل بوده و آروماتیک بودن مولکول پیریین تایید میشود.

تیوفن
«تیوفن» (Thiophene)، آنالوگِ گوگرد فوران، حلقوی بوده و میبینیم که در تمامی اطراف حلقه مزدوج شده و دارای دو پیوند پای است.
نکته جالب در مورد تیوفن و فوران این است که اگرچه دارای دو جفت غیرپیوندی در حلقه هستند، اما فقط میتوانیم یکی از جفتها را بشماریم. هر اتم حداکثر میتواند با یک اوربیتال و دو الکترون در آروماتیک بودن مشارکت داشته باشد. جفت غیرپیوندی دیگر که در صفحه حلقه قرار دارد، بسیار شبیه جفت غیرپیوندی روی نیتروژن پیریدین در مثال بررسی شده در بالا است. بنابراین تیوفن در مجموع، شش الکترون پای دارد که عدد هوکل بوده و آروماتیک است.

سیکلوبوتادین
«سیکلوبوتادین» (Cyclobutadiene) حلقوی و مزدوج است. دارای دو پیوند پای است و جفتغیرپیوندی ندارد. دو پیوند پای در مجموع ۴ الکترون پای به ما میدهد که عدد هوکل نیست. پس مانند کاتیون سیکلوپنتادینیل در بالا، این ترکیب نیز آروماتیک نخواهد بود.

سیکلوبوتادین دیآنیون
«سیکلوبوتادین» آروماتیک نیست، ولی اگر به نحوی دو الکترون به آن پمپ کنیم و «سیکلوبوتادین دیآنیون» (Cyclobutene Di-Anion) داشته باشیم، وضعیت تغییر خواهد کرد. دیآنیون سیکلوبوتادین حلقوی و مزدوج است. یک پیوند $$pi$$ داشته و دو کربن دارای جفت غیرپیوندی هستند که میتوانند در سیستم پای قرار گرفته و در مجموع شش الکترون پای به ما بدهند که جزو اعداد هوکل است، بنابراین سیکلوبوتادین دیآنیون آروماتیک است.

نفتالن
«نفتالن یا نفتالین» (Naphthalene) دو حلقه دارد، یعنی ترکیب «دو حلقوی» (Bicyclic Compound) است. در اطراف حلقهها مزدوج شده و در مجموع ۵ پیوند پای داریم و جفت غیرپیوندی نیز نداریم، پس در مجموع ۱۰ الکترون پای خواهیم داشت که جزو اعداد هوکل است. پس نفتالن با پوشش به تمامی قوانین آروماتیک بودن، در رده ترکیبات آروماتیک جای میگیرد.

یون پیریلیم
«یون پیریلیم» (Pyrylium Ion) حلقوی شش عضوی بوده و مانند بنزن دارای سه پیوند پای است. نیز دارای یک جفت غیرپیوندی روی اکسیژن است. مانند پیریدین و آنیون بنزن، این جفت غیرپیوندی در زوایای قائم نسبت به سیستم پای قرار دارد، پس در واقع جزء آروماتیک بودن آنها به حساب نمیآید، بنابراین مولکول غیرپیوندی دارای ۶ الکترون در سیستم پای بوده و آروماتیک است.

ایندول
«ایندول» (Indole) یک مولکول دو حلقوی است، شبیه یک مولکول بنزن که به مولکول پیرول فیوز یا همجوش شده است. این مولکول مزدوج است و هر اتم در اطراف دو حلقه، در سیستم پای شرکت میکند، پس در مجموع دارای ۴ پیوند پای و یک جفت الکترون غیرپیوندی بر روی نیتروژن است که در سیستم پای شرکت دارد. در مجموع ۱۰ الکترون پای خواهیم داشت که عدد هوکل بوده و نتیجه میگیریم که ایندول آروماتیک است.

آزولن
«آزولن» (Azulene) نمونه دیگری از یک مولکول دو حلقوی است، مانند نفتالین و ایندول که در قسمتهای بالاتر بررسی کردیم. این مولکول در سراسر محیط سیستم پای مزدوج شده است. پنج پیوند پای دارد و جفت غیرپیوندی نیز وجود ندارد، یعنی در مجموع ۱۰ الکترون پای داریم که عدد هوکل است، پس آزولن نیز آروماتیک است.

شاید تجسم آزولن به عنوان ترکیب آروماتیک، کمی چالش برانگیز باشد، ولی ترسیم فرم رزونانس که در آن به نظر میرسد هر دو حلقه دارای اجزای آروماتیک هستند، میتواند کمککننده باشد، برای مثال، در شکل رزونانس زیر، میتوانیم آزولن را به عنوان ترکیبی از کاتیون سیکلوهپتاترین (آروماتیک) که به آنیون سیکلوپنتادین (آروماتیک) فیوز شده، در نظر بگیریم.
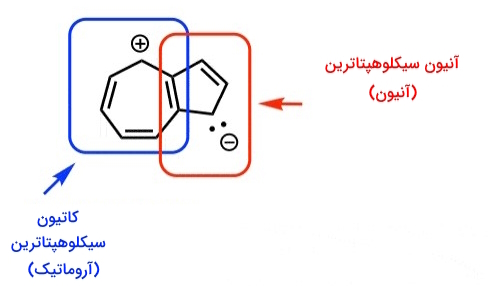
توجه داشته باشیم که یک از حلقهها دارای بار منفی و دیگری دارای بار مثبت است. معلوم میشود که این فرم رزونانس، مشارکت قابل توجهی در هیبرید دارد، چون آزولن خود دارای «ممان یا گشتاور دوقطبی» (Dipole Moment) قابلتوجهی بوده(۱.۰۸ D)، در مقابل، نفتالن فاقد هر گونه گشتاور دوقطبی است.
خلاصه مباحث
هدف مقاله حاضر از مجله فرادرس، آشنایی با ویژگی آروماتیسیته در مولکولها بود تا یاد بگیریم نحوه تشخیص آروماتیک چیست. در این راستا به تشریح چهار قانون مهم و لازم برای داشتن این ویژگی در مولکولها پرداختیم که عبارتند از: داشتن ساختار حلقوی، مزدوج بودن اتمها در حلقه، داشتن $$۴n+۲$$ الکترون پای و صاف یا مسطح بودن مولکول. در قسمت آخر نحوه به کارگیری این قوانین را با استفاده از رسم جدول مطرح کردیم که به ساماندهی اطلاعات یادگرفته شده در ابتدای مسیر مهارتافزاییِ تشخیص ترکیبات آروماتیک کمک میکند.
source
