جدول تناوبی عناصر، جدولی متشکل از ۷ ردیف و ۱۸ ستون است که در آن عناصر شیمیایی به ترتیب افزایش عدد اتمی قرار گرفتهاند. هر گروه جدول تناوبی شامل عناصری است که خواص شیمیایی مشابهی دارند و هر ردیف جدول تناوبی شامل عناصری است که دارای تعداد لایههای الکترونی برابری هستند. در این مطلب از مجله فرادرس میآموزیم دوره و گروه در جدول تناوبی چیست.
آنچه در این مطلب میآموزید:
-
مفهوم دوره و گروه را در جدول تناوبی میآموزید و عناصر آنها را میشناسید.
-
میتوانید تفاوت دوره و گروه را درک کرده و با شمارههای هر دوره و گروه آشنا شوید.
-
با خواص هر دوره و گروه در جدول تناوبی و نامهای آنها آشنا میشوید.
-
میآموزید چگونه شماره دوره و گروه یک عنصر در جدول تناوبی را بیابید.
-
با سایر دستهبندیها در جدول تناوبی آشنا میشوید.
-
خواص و قانون دورهای عناصر در جدول تناوبی را مرور میکنید.



در ابتدای این مطلب میآموزیم تعریف دوره و گروه در جدول تناوبی چیست. سپس به بررسی تفاوت آنها و خواص هریک از آنها میپردازیم. در ادامه، یاد میگیریم چگونه دوره و گروه عناصر را تعیین کنیم. پس از آن سایر دستهبندیهای رایج عناصر را آموخته و خواص دورهای عناصر را بررسی میکنیم. با مطالعه این مطلب تا انتها میتوانید به شکلی کامل با دوره و گروه در جدول تناوبی آشنا شوید.
دوره و گروه در جدول تناوبی
دوره و گروه در جدول تناوبی روشی برای دستهبندی عناصر در جدول تناوبی است. دورهها، ردیفهایی افقی هستند که در هر یک از آنها تعناصر متفاوتی قرار گرفته که تعداد لایههای الکترونی برابر دارند. گروه در جدول تناوبی، ستونهای عمودی هستند که در هر یک از آنها عناصر متفاوتی قرار دارد که تعدادخواص شیمیایی مشابهی دارند و بر اساس افزایش عدد کوانتومی اصلی با تعداد الکترون ظرفیت برابر مرتب شدهاند.
دستهبندی عناصر در دوره و گروه در جدول تناوبی به شیمیدانان کمک کرده بتوانند خواص دورهای عناصر و رفتار شیمیایی عناصر در ترکیبات و واکنشهای مختلف را بهتر درک کنند.
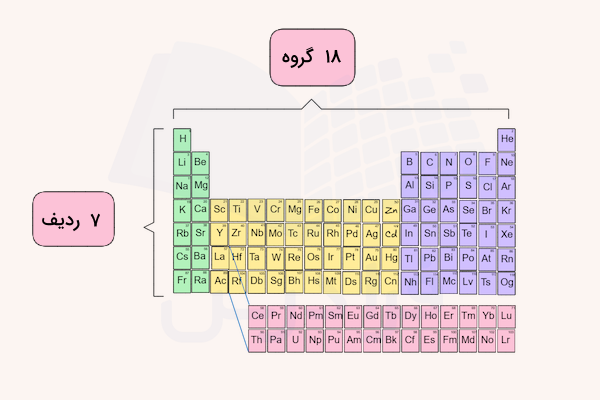
گروه در جدول تناوبی
عناصری که در یک گروه در جدول تناوبی قرار گرفتهاند، تعداد الکترون ظرفیت برابری دارند. برای مثال، فلزات گروه اول جدول تناوبی، همگی دارای یک الکترون ظرفیت هستند که با از دست دادن آن کاتیون ۱+ تولید میکنند. عناصر موجود در یک گروه جدول تناوبی معمولا تعدادی خواص شیمیایی مشابه دارند.
در ادامه، نام و دستهبندی این گروهها مشخص شده است. عناصر موجود در گروههای جدول تناوبی معمولا در یک خانواده شناخته و بررسی میشوند که نام خانواده بر اساس اولین عنصر گروه بررسی میشود. برای مثال به گروه ۱۶ جدول تناوبی گروه (خانواده) اکسیژن نیز گفته میشود. از طرفی، برخی از گروهها مانند هالوژنها و فلزات قلیایی، نامهای عمومی شناخته شده دارند.
| شماره گروه جدول تناوبی | نام گروه (خانواده) |
| گروه ۱ | خانواده لیتیوم (گروه فلزات قلیایی) |
| گروه ۲ | خانواده برلیم (گروه فلزات قلیایی خاکی) |
| گروه ۳ | خانواده اسکاندیوم |
| گروه ۴ | خانواده تیتانیوم |
| گروه ۵ | خانواده وانادیم |
| گروه ۶ | خانواده کروم (گروه کرومیم) |
| گروه ۷ | خانواده منگنز |
| گروه ۸ | خانواده آهن |
| گروه ۹ | خانواده کبالت |
| گروه ۱۰ | خانواده نیکل |
| گروه ۱۱ | خانواده مس (گروه فلزات مسکوک) |
| گروه ۱۲ | خانواده روی (گروه فلزات فرار) |
| گروه ۱۳ | خانواده بور (گروه ایکوزاژن) |
| گروه ۱۴ | خانواده کربن (گروه ترترل،کریستالوژن) |
| گروه ۱۵ | خانواده نیتروژن (گروه پنتل، پنیکتروژن) |
| گروه ۱۶ | خانواده اکسیژن (گروه کالکوژن) |
| گروه ۱۷ | خانواده فلوئور (گروه هالوژن) |
| گروه ۱۸ | خانواده هلیوم یا نئون ( گروه گاز نجیب، آئروژن) |
ردیف در جدول تناوبی
جدول تناوبی عناصر از ۷ ردیف افقی تشکیل شدهاست که عناصر موجود در آن تعداد لایه الکترونی برابری دارند. این بدین معنا است که الکترونهای ظرفیت این عناصر، عدد کوانتومی اصلی برابری دارند. برای مثال، در ردیف دوم جدول تناوبی، عناصر لیتیوم، برلیم، بور و … همگی دارای ۲ لایه الکترونی هستند. در لایه دوم الکترونی ۲ اوربیتال 2s و 2p به ترتیب با افزایش عدد اتمی عناصر، با الکترونها پر میشود. سایر دورههای جدول تناوبی نیز به همین ترتیب هستند. در ادامه ردیفهای جدول تناوبی معرفی شده است.
- ردیف ۱: عناصر هیدروژن و هلیوم
- ردیف ۲: لیتیوم، برلیم، بور، کربن، نیتروژن، اکسیژن، فلوئور، نئون
- ردیف ۳: سدیم، منیزیم، آلومینیوم، سیلیسیم، فسفر، گوگرد، کلر، آرگون
- ردیف ۴: پتاسیم، کلسیم، اسکاندیم، تیتانیوم، وانادیم، کروم، منگنز، آهن، کبالت، نیکل، مس، روی، گالیم، ژرمانیم، آرسنیک، سلنیوم، برم، کریپتون
- ردیف ۵: روبیدیم، استرانسیم، ایتریم، زیرکونیوم، نیوبیم، مولیبدن، تکنسیم، روتنیم، پالادیم، نقره، کادمیوم، ایندیم، قلع، آنتیموان، تلوریم، ید، زنون
- ردیف ۶: سزیم، باریم، لانتان (و سایر عناصر ردیف لانتانیدها)، هافنیم، تانتال، تنگستن، رنیوم، اسمیم، ایریدیم،پلاتین، طلا، جیوه، تالیم، سرب، بیسموت، پولونیوم، استاتین، رادون
- ردیف ۷: فرانسیم، رادیم، اکتینیم (و سایر عناصر ردیف اکتینید)، رادرفوردیم، دوبنیم، سیبورگیم، بوریم، هاسیم، مایتنریم، دارمشتادیوم، رونتگنیوم، کوپرنیسیم، نیهونیم، فلروویم، مسکوویم، لیورموریم، تنسین، اوگانسون
نام فارسی عناصر نوشته شده در بالا بهتر است به همراه نماد شیمیایی آنها به خاطر سپرده شود. پیشنهاد میکنیم برای یادگیری بهتر این موارد، مطلب نام عناصر جدول تناوبی به فارسی مجله فرادرس را مطالعه کنید. تعداد عناصر موجود در هر ردیف جدول تناوبی در ادامه آورده شده است.
| شماره دوره جدول تناوبی | تعداد عناصر |
| دوره ۱ | ۲ |
| دوره ۲ | ۸ |
| دوره ۳ | ۸ |
| دوره ۴ | ۱۸ |
| دوره ۵ | ۱۸ |
| دوره ۶ | ۳۲ |
| دوره ۷ | ۳۲ |
دانلود PDF با کیفیت جدول تناوبی
در ادامه این مطلب، لینکهای دانلود عکس و PDF جدول تناوبی عناصر با کیفیت بالا قرار گرفته است. میتوانید با کلیک بر روی لینکهای زیر فایل PDF جدول تناوبی عناصر و عکس جدول تناوبی عناصر را دانلود کنید.
فایل PDF جدول تناوبی فارسی به همراه تقلبنامه جدول تناوبی از لینکهای زیر قابل دانلود هستند. برای دانلود این فایلها، روی آنها کلیک کنید.
تفاوت دوره و گروه در جدول تناوبی
تمامی عناصر کشف شده تا به امروز در جدول تناوبی عناصر مرتب شدهاند. این جدول شامل ۱۸ گروه و ۷ دوره است. عناصر هر دوره در تعداد لایههای الکترونی مشترک هستند و عناصر هر گروه آرایش الکترونی لایه ظرفیت تقریبا مشابه و تعداد الکترون ظرفیت برابری دارند. در ادامه تفاوت گروه و دوره در جدول تناوبی را توضیح میدهیم.
| دوره جدول تناوبی | گروه جدول تناوبی |
| ردیفهای افقی | ستونهای عمودی |
| ۷ دوره | ۱۸ گروه |
| تعداد لایههای الکترونی برابر عناصر | تعداد الکترونهای ظرفیت برابر عناصر |
| خواص عناصر از فلزی به نافلزی تغییر میکند. | خواص عناصر در یک گروه مشابه است. |
| شعاع اتمی از چپ به راست کاهش مییابد. | شعاع اتمی از بالا به پایین افزایش مییابد. |
جدول تناوبی عناصر ساختار ثابت و مشخصی دارد و به عنوان مرجعی برای مطالعه نام و خواص عناصر استفاده میشود. در ادامه برخی از خواص این جدول آورده شده است.
- ردیفهای افقی دوره نامیده میشوند.
- ستونهای عمودی گروه نامیده میشوند.
- عناصر یک گروه به یکدیگر شبیه هستند.
- فلزات در سمت چپ و غیرفلزات در سمت راست قرار دارند.
- گروههای اصلی از ۱ تا ۷ شمارهگذاری شدهاند و آخرین گروه در سمت راست گروه ۰ یا ۸ است.
- بلوک بین گروه ۲ و گروه ۳، محل قرارگیری فلزات واسطه است.
- در دوره ۱ تنها دو عنصر وجود دارد: هیدروژن و هلیوم.
- خط زیگزاگ در این جدول، فلزات را در سمت چپ و غیرفلزات را در سمت راست جدا میکند.
- هیدروژن یک غیرفلز است اما اغلب در وسط جدول یا بالای گروه اول قرار داده میشود.
- اکثر عناصر فلز هستند.
- هر عنصر نماد شیمیایی خود را دارد که از حروف انگلیسی ساخته شده است.
- در جدول تناوبی فقط عناصر وجود دارند و هیچ ترکیبی قرار ندارد.
شماره دوره و گروه در جدول تناوبی
گروههای جدول تناوبی به صورت عددی از ۱ تا ۱۸ شمارهگذاری میشوند، از ستون سمت چپ (فلزات قلیایی) تا ستون سمت راست (گازهای نجیب). گروههای بلوک f در این شمارهگذاری لحاظ نمیشوند. قبلا گروهها با اعداد رومی مشخص میشدند. اگر گروه در بلوک s یا p بود، حرف «A» و اگر در بلوک d بود، حرف «B» به آن اضافه میشد. اعداد رومی به گونهای بودند که آخرین رقم آنها با سیستم عددی امروزی مطابقت داشت. برای مثال عناصر گروه ۴، IVB و عناصر گروه ۱۴، IVA نامیده میشدند.
هر گروه همچنین میتواند با نام اولین عنصر خود نامگذاری شود، مثلا گروه ۳ «گروه اسکاندیوم» نامیده میشود. سیستم شمارهگذاری جدید IUPAC از سال ۱۹۸۸ استفاده میشود و نامهای قدیمی دیگر معتبر نیستند.
خواص دوره و گروه در جدول تناوبی
در قسمتهای قبل آموختیم که عناصر موجود در هر دوره جدول تناوبی، عناصری وجود دارند که لایه الکترونی مشابهی دارند و در هر گروه جدول تناوبی، عناصری با تعداد الکترون ظرفیت برابر و خواص شیمیایی مشابه وجود دارد. این شباهتها و خواص دورهای باعث میشود که هر یک از این ردیفها و گروهها خواصی مشخص داشته باشند که تقریبات در تمامی عناصر آنها وجود دارد. در ادامه خواص دورهها و گروههای جدول تناوبی را به شکل خلاصه بررسی میکنیم.
گروه اول: فلزات قلیایی
گروه فلزات قلیایی، اولین گروه در جدول تناوبی عناصر است که تمامی عنصرهای آن فلز بوده و بسیار واکنشپذیر هستند. آرایش الکترونی لایه ظرفیت این عناصر به شکل زیر است.
عدد n در این آرایش نمایش دهنده لایه آخر الکترونی (ردیف جدول تناوبی) عناصر است. برای مثال، عنصر پتاسیم که در گروه اول و ردیف ۴ جدول تناوبی قرار دارد، آرایش الکترونی لایه ظرفیت آن به ختم میشود. این فلزات با از دست دادن این الکترون ظرفیت میتوانند کاتیون ۱+ تشکیل دهند. در ادامه برخی دیگر از خواص عناصر گروه اول جدول تناوبی را نام میبریم.
- واکنشپذیری زیاد
- حساس به آب (واکنش شدید)
- نرم
- چگالی کم
- نقطه ذوب پایین
- نقطه جوش پایین
گروه دوم: فلزات قلیایی خاکی
گروه دوم عناصر جدول تناوبی (خانواده برلیم) که با نام گروه فلزات قلیایی خاکی شناخته میشود از فلزاتی تشکیل شده که همگی دو الکترون ظرفیت داشته و میتوانند کاتیون ۲+ تولید کنند. آرایش الکترونی تمامی این عناصر به شکل زیر است.
این عناصر نسبت به فلزات قلیایی کمتر واکنشپذیرند اما عوامل کاهنده خوب و قوی هستند و به خوبی رسانای الکتریکی هستند. در ادامه خواص این عناصر را نام میبریم.
- عوامل کاهنده قوی
- فلزات براق نقرهای رنگ
- رسانای خوب الکتریسیته
- چگالی پایین
- نقطه ذوب پایین
- نقطه جوش پایین
گروه ۳ تا ۱۱: فلزات واسطه
فلزات واسطه عناصری هستند که در گروههای ۳ تا ۱۲ جدول تناوبی قرار دارند. این فلزات آرایش الکترونی ویژهای دارند که در آن الکترونها زیر لایه درونی d را پر میکنند. این فلزات میتوانند چندین حالت اکسایش داشته و ترکیبات متنوع و متعددی را تشکیل دهند. برخی از این فلزات مانند طلا، پلاتین، نقره و مس از انواع فلزات گرانبها هستند.
آرایش الکترونی این فلزات به شکل زیر است.
در این آرایش الکترونی n آخرین لایه الکترونی است. بدین ترتیب فلزات واسطه میتوانند آرایش الکترونی متفاوتی را در هر گروه اختیار کنند. برخی از فلزات واسطه که اوربیتال d پر یا نیمهپر دارند، از پایداری نسبی بیشتری برخوردارند. در ادامه برخی دیگر از ویژگیهای فلزات واسطه معرفی شده است.
- انرژی یونش پایین
- رسانایی بالا
- نقطه ذوب و جوش بالا
- جلای فلزی
- چکشخوار
گروه ۱۷: هالوژن ها
هالوژن از واژهای یونانی به معنی تشکیل دهنده نمک گرفته شده است. این عناصر غیرفلزی بوده و ۷ الکترون در لایه ظرفیت خود دارند. فرمول عمومی آرایش الکترونی هالوژنها به شکل زیر است.
همانطور که مشاهده میکنید این عناصر با دریافت یک الکترون میتوانند به آرایش گاز نجیب رسیده و پایدار شوند. به همین دلیل این عناصر بسیار واکنش پذیر و فعال هستند و میتوانند آنیون ۱- تشکیل دهند. به این علت، ترکیبات بسیار زیاد و متنوعی از عناصر هالوژن وجود دارد. این گروه از جدول تناوبی شامل هر سه حالت ماده مایع، جامد و گاز است. همچنین، این گروه از جدول تناوبی بالاترین مقادیر الکترونگاتیوی را دارند.
گروه ۱۸: گازهای نجیب
گازهای نجیب عناصری هستند که در آنها تمامی زیرلایههای الکترونی پر هستند و کمترین مقدار واکنشپذیری را دارند. این عناصر به فرم تک اتمی و گازی یافت میشوند و فرم کلی آرایش الکترونی آنها مشابه زیر است.
در این آرایش الکترونی، تمامی زیرلایههای اتمها پر هستند. این آرایش الکترونی، پایدارترین فرم آرایش الکترونی است که سبب پایداری بسیار زیاد گازهای نجیب میشود. به همین دلیل است که این گازها تمایلی به دریافت یا از دست دادن الکترون و تشکیل پیوند و ترکیب شیمیایی ندارند. در ادامه برخی از ویژگیهای گازهای نجیب معرفی شده است.
- نقطه جوش پایین
- نقطه ذوب پایین
- بدون رنگ
- بدون بو
لانتانیدها
لانتانیدها عناصری با عدد اتمی ۵۷ تا ۷۰ هستند. این عناصر که فلزی هستند در ردیف ششم جدول تناوبی قرار گرفتهاند. این فلزات زیرلایههای 5d و 5f را دارند و به شدت واکنشپذیر هستند. همچنین این فلزات درخشنگی نقرهای روشنی دارند و نسبتا نرم هستند. آرایش الکترونی این عناصر به شکل زیر است.
این فلزات نقطه ذوب و جوش بالایی دارند. عناصری مانند نئودیم (Nd) و اربیوم (Er) در این دسته هستند.
اکتینیدها
اکتینیدها عناصری با عدد اتمی ۸۹ تا ۱۰۲ هستند و در ردیف هفتم جدول تناوبی قرار دارند. این فلزات به همراه لانتانیدها در دو ردیف جداگانه زیر جدول تناوبی مشخص میشوند. این فلزات نیز مانند لانتانیدها به شدت واکنشپذیر هستند. همچنین این عناصر الکتروپوزیتیو و رادیواکتیو هستند. آرایش الکترونی این عناصر به شکل زیر است.
برخی دیگر از ویژگیهای اکتینیدها در ادامه مشخص شده است.
- خاصیت پارامغناطیسی و آلوتروپی
- ظاهر براق و نقرهای
- نرم و چکشخوار
- رسانا
پیشنهاد میکنیم برای آشنا بیشتر با این دو دسته از عناصر، فیلم آموزش لانتانید و اکتینید در جدول تناوبی فرادرس که لینک آن در ادامه آورده شده است را مشاهده کنید.
دوره هفتم و عناصر مصنوعی
اکثر نسخههای اخیر جدول تناوبی دوره هفتم را کامل نشان نمیدهند. بسیاری از عناصر این دوره قبل از اوایل قرن بیستم شناخته نشده بودند. برخی عناصر مصنوعی با بمباران عناصر شناخته شده توسط ذرات زیراتمی مانند نوترون یا ذره آلفا تولید میشوند. برای مثال، اورانیوم برای تولید عناصر با عدد اتمی ۹۳ تا ۱۰۰ استفاده شده است. عناصر بزرگتر (عدد اتمی ۱۰۱ به بالا) با همجوشی هستههای عناصر کوچکتر تولید میشوند.

در تصویر بالا عناصر اکتنید در ردیف هفتم بازنویسی نشده است. عناصر مصنوعی، معمولا بسیار ناپایدار هستند و گاهی کمتر از یک ثانیه وجود دارند، بنابراین اطلاعات کمی درباره آنها موجود است. عناصر تا عدد اتمی ۱۱۲ شناخته شدهاند و شواهدی برای عناصر ۱۱۳ به بالا نیز ارائه شده است. عناصر ۱۱۴ و ۱۱۶ در سال ۲۰۱۱ به جدول اضافه شدند و در سال ۲۰۱۵، IUPAC وجود چهار عنصر جدید ۱۱۳، ۱۱۵، ۱۱۷ و ۱۱۸ را تایید کرد و آنها را به جدول اضافه نمود.
- عنصر ۱۱۳: Nihonium (Nh)،نهیونیوم نام آن از کلمه ژاپنی Nihon به معنی ژاپن گرفته شده است.
- عنصر ۱۱۵: Moscovium (Mc)، مسکوویم نامگذاری شده توسط تیمی از روسیه و آمریکا، از مسکو گرفته شده است.
- عنصر ۱۱۷: Tennessine (Ts)، تنسین نامگذاری شده توسط همان تیم، از تنسی گرفته شده است.
- عنصر ۱۱۸: Oganesson (Og)، اوگانسون توسط تیم روسی کشف شده و به افتخار یوری اوگانیسان نامگذاری شده است، که کاشف برجسته عناصر است.
تشخیص دوره و گروه در جدول تناوبی
برای تشخیص دوره و گروه جدول تناوبی عناصر میتوانیم با استفاده از آرایش الکترونی مکان عنصر را تشخیص دهیم. در ادامه این روش را توضیح میدهیم.
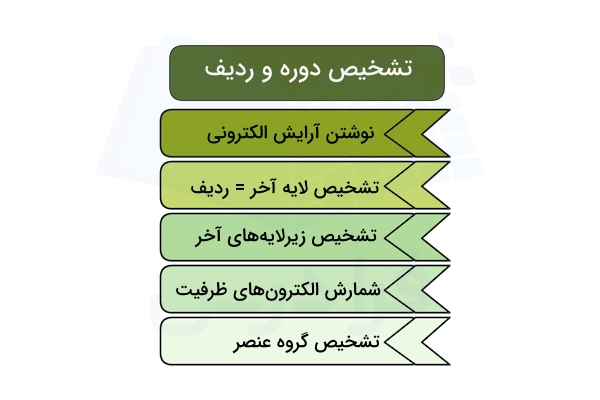
تشخیص با استفاده از آرایش الکترونی
برای تشخیص مکان عناصر با استفاده از آرایش الکترونی، باید ابتدا آرایش الکترونی عنصر را با استفاده از عدد اتمی آن و اصل آفبا بنویسیم. سپس آخرین لایه الکترونی (لایه ظرفیت) آن را تشخیص داده و با توجه به آن میتوانیم دوره و گروه جدول تناوبی را تشخیص دهیم. بیشترین عددی که به عنوان لایه اصلی (عدد کوانتومی اصلی n) برای عنصر وجود دارد، شماره دوره آن است.
تشخیص گروه عنصر نیز با توجه به زیرلایههای لایه ظرفیت آن مشخص میشود. برای مثال، زیرلایه s نشان دهنده گروه ۱ و ۲ است و زیرلایه p در گروههای ۱۳ تا ۱۸ پر میشود. در ادامه، شماره گروه و شکل آرایش الکترونی لایه آخر عناصر مشخص شده است.
| شماره گروه | آرایش الکترونی |
| ۱ | |
| ۲ | |
| ۳ | |
| ۴ | |
| ۵ | |
| ۶ | |
| ۷ | |
| ۸ | |
| ۹ | |
| ۱۰ | |
| ۱۱ | |
| ۱۲ | |
| ۱۳ | |
| ۱۴ | |
| ۱۵ | |
| ۱۶ | |
| ۱۷ | |
| ۱۸ |
مرحله ۱: نوشتن آرایش الکترونی
طیق اصل آفبا، الکترونهای عناصر به ترتیب زیر لایهها و زیرلایههای الکترونی را پر میکنند. برای نوشتن آرایش الکترونی عناصر باید ترتیب این اصل و تعداد الکترون هر زیرلایه را حفظ کنیم.
هر یک از این زیرلایهها میتوانند تعداد مشخصی الکترون را در خود جای دهند. در ادامه ظرفیت هر یک از این زیرلایهها مشخص شده است.
| زیرلایه | ظرفیت |
| s | ۲ |
| p | ۶ |
| d | ۱۰ |
| f | ۱۴ |
بدین ترتیب میتوانیم آرایش الکترونی عناصر را بنویسیم. برای مثال، آرایش الکترونی عنصری با عدد اتمی ۲۹ (دارای ۲۹ الکترون) به شکل زیر خواهد بود.
مرحله ۲: تشخیص لایه ظرفیت
تشخیص لایه ظرفیت و الکترون ظرفیت با استفاده از آرایش الکترونی بسیار راحت است. تنها کافی است به شماره اعداد کوانتومی اصلی (n) در آرایش الکترونی عنصر توجه کنیم. آن قسمتی از آرایش الکترونی که بیشترین n را دارد مربوط به لایه ظرفیت است که میتواند شامل آخرین زیرلایههای s یا (s و p) باشد. برای مثال، به آرایش الکترونی و لایه ظرفیت موارد زیر توجه کنید.
سدیم: (دوره ۳)
کلر: (دوره ۳)
آهن: (دوره ۴)
سریم: (دوره ۶)
توجه کنید که در فلزات واسطه، لانتانیدها و اکتینیدها، زیرلایههای d و f نیز عموما جزو لایه ظرفیت عنصر به حساب میآیند. زیرا الکترونها این زیرلایههای درونی را پر میکنند. بدین ترتیب، آرایش الکترونی لایه ظرفیت عناصر میتوانید یکی از اشکال زیر باشد.
| آرایش الکترونی لایه ظرفیت | گروه در جدول تناوبی |
| گروه ۱ و ۲ (قطعه s) | |
| گروه ۱۳ تا ۱۸ (قطعه p) | |
| فلزات واسطه (قطعه d) | |
| لانتانیدها و اکتینیدها(قطعه f) |
جدول تناوبی عناصر بر اساس این آرایشهای الکترونی به چهار قطعه (بلوک) s و p و d و f تقسیم میشود.
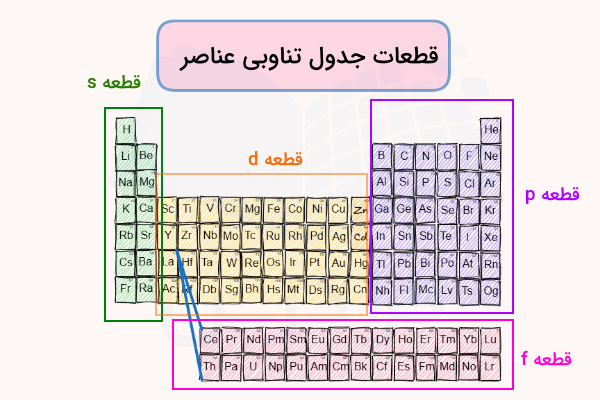
مرحله ۳: شمارش الکترونهای ظرفیت
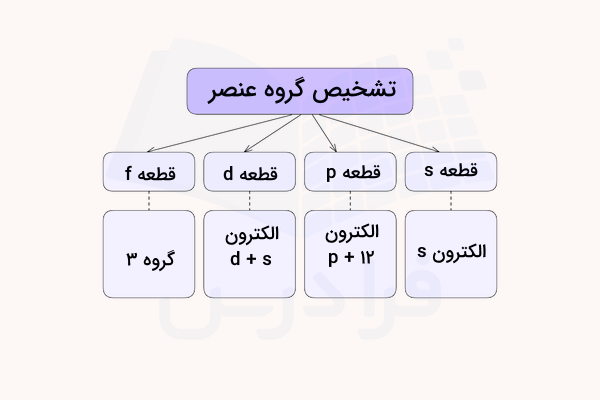
در قسمتهای قبل آموختیم که آرایش الکترونی هر دوره و گروه در جدول تناوبی به زیرلایههای مشخص با تعداد الکترونهای مشخص ختم میشود. بدین ترتیب میتوان با تشخیص تعداد الکترونهای ظرفیت گروه عنصر و با استفاده از شماره آخرین لایه الکترونی، ردیف آن را تشخیص داد. برای مثال، در قطعه s تعداد الکترونهای موجود در لایه ظرفیت مشخص کننده شماره گروه (۱ یا ۲) است. در ادامه، این روش تشخیص را توضیح میدهیم.
| آرایش الکترونی لایه ظرفیت | تشخیص شماره گروه |
| شماره گروه = تعداد الکترون s | |
| شماره گروه = تعداد الکترون p + ۱۲ | |
| شماره گروه = تعداد الکترون s+d | |
| لانتانیدها و اکتینیدها |
به دلیل موقعیت خاص عناصر لانتانید و اکتینید در جدول تناوبی، شماره گروه آنها در سوالات خواسته نمیشود و تنها تشخیص لانتانید یا اکتینید بودن عنصر کافی است. تمامی عناصر لانتانید و اکتینید به صورت قراردادی و با توجه به آرایش الکترونی آنها که شامل است، متعلق به گروه ۳ در نظر گرفته میشوند.
مثال تشخیص دوره و گروه در جدول تناوبی
در قسمت قبل آموختیم چگونه میتوان دوره و گروه را با توجه به آرایش الکترونی عنصر یافت. در ادامه مثالهایی را برای تشخیص گروه و دوره در جدول تناوبی بررسی میکنیم.
مثال ۱
مکان عنصر اکسیژن را در جدول تناوبی مشخص کنید. عدد اتمی این عنصر برابر با ۸ است.
پاسخ
ابتدا با توجه به عدد اتمی عنصر، آرایش الکترونی آن را طبق اصل آفبا مینویسیم.
با توجه به آرایش الکترونی این عنصر، بیشترین عدد کوانتومی اصلی ۲ است. بنابراین اکسیژن به ردیف دوم جدول تناوبی تعلق دارد. سپس زیرلایههای آن را بررسی میکنیم. در لایه دوم دو زیرلایه s و p الکترون دارند. بنابراین این عنصر متعلق به قطعه p بوده و شماره گروه آن (۱۲ + تعداد الکترون p) برابر با ۱۶ است.
مثال ۲
برای عنصری با عدد اتمی ۱۷، دوره و گروه در جدول تناوبی را مشخص کنید.
پاسخ
ابتدا آرایش الکترونی عنصر را مینویسیم.
با توجه به آرایش الکترونی بیشترین مقدار n برابر با عدد ۳ است پس این عنصر متعلق به دوره سوم است. سپس به زیرلایهها توجه میکنیم. لایه ظرفیت این عنصر متعلق به قطعه p بوده و شماره گروه آن برابر با ۱۲+۵ = ۱۷ و گروه هالوژنها است.
مثال ۳
برای عنصری با عدد اتمی ۳۴، دوره و گروه در جدول تناوبی را مشخص کنید.
پاسخ
ابتدا آرایش الکترونی عنصر را مینویسیم.
با توجه به این آرایش الکترونی، این عنصر متعلق به دوره چهارم جدول تناوبی (4 = n) است. باید توجه داشته باشیم که در لایه ظرفیت این عنصر، اوربیتالهای 3d وجود دارند پس این عنصر متعلق به قطعه d و یکی از عناصر فلزات واسطه است. شماره گروه این عنصر برابر با جمع الکترونهای 3d و 4s و برابر با گروه ۱۲ است.
برای درک بهتر این روش تشخیص دوره و گروه در جدول تناوبی، تمرینهای زیر را حل کنید.
تمرین ۱
شماره گروه و ردیف عنصری با عدد اتمی ۲۴ را در جدول تناوبی پیدا کنید.
ابتدا آرایش الکترونی عنصر را مینویسیم.
در نوشتن آرایش الکترونی این عنصر باید دقت زیادی به خرج دهیم. آرایشهای الکترونی و در فلزات واسطه به دلیل ناپایداری نسبت به آرایش پر و نیمهپر زیرلایه d، وجود ندارد. به همین دلیل در این موارد یک الکترون از زیرلایه ns به زیرلایه منتقل شده و الکترونها این زیرلایه را پر یا نیمهپر میکنند. به همین دلیل است که آرایش الکترونی کروم به شکل بالا نوشته میشود. بیشترین n در این آرایش برابر ۴ (دوره ۴) است و شماره گروه آن برابر با ۱+۵=۶ میشود.
تمرین ۲
شماره گروه و ردیف عنصری با عدد اتمی ۵۸ در جدول تناوبی کدام است.
لانتانیدها گروه ۳
لانتانیدها گروه ۴
اکتنیدها گروه ۳
اکتنیدها گروه ۴
ابتدا آرایش الکترونی عنصر را مینویسیم.
این آرایش الکترونی مربوط به قطعه f است. در قسمتهای قبل اشاره کردیم که لانتانیدها و اکتنیدها در گروه ۳ جدول تناوبی جای دارند و با توجه به آخرین لایه الکترونی (بیشترین n) شماره لایه آنها مشخص میشود. پس این عنصر متعلق به گروه ۳ و ردیف ۶ (لانتانیدها) است.
تمرین ۳
شماره گروه و ردیف عنصری با عدد اتمی ۹۳ در جدول تناوبی کدام است.
لانتانیدها گروه ۳
لانتانیدها گروه ۴
اکتنیدها گروه ۳
اکتنیدها گروه ۴
ابتدا آرایش الکترونی عنصر را مینویسیم.
با توجه به این آرایش الکترونی، این عنصر متعلق به قطعه f است. پس گروه آن گروه سوم جدول تناوبی است و ردیف را با توجه به بیشترین n تعیین میکنیم. پس این عنصر به ردیف ۷ جدول تناوبی و اکتنیدها تعلق دارد.
سایر دستهبندی عناصر جدول تناوبی
روش دیگری برای دستهبندی عناصر و بررسی خواص آنها وجود دارد که در آن عناصر بر اساس خواصشان گروهبندی میشوند. این گروهها لزوما گروههای عمودی جدول تناوبی نیستند و میتوانند شامل چند عنصر در ردیفها و گروههای مختلف باشند. برای مثال، عناصر فلزات واسطه به صورت جداگانه بررسی میشوند که این عناصر در چندین گروه جدول تناوبی قرار دارند و در قسمتهای قبلی این مطلب از مجله فرادرس توضیح داده شدهاند. در ادامه این دستهبندیها را نام میبریم.
- فلزات پساواسطه
- لانتانیدها
- اکتینیدها
- فلزات ساده
- شبهفلزات
- نافلزات
- هالوژنها
- فلزات نجیب
- قطعه (بلوک)های s و p و d و f
در ادامه این دستهبندیها را بررسی میکنیم.
فلزات ساده
فلزات ساده به آن دسته از عناصر فلزی گفته میشود که در طبیعت میتوان آنها را به صورت خالص و تکعنصری یافت و معمولا با عنصر یا ترکیب شیمیایی دیگری ترکیب نمیشوند. این فلزات ویژگیهای کلاسیک فلزی مانند چکشخواری، شکلپذیری، جلای فلزی، رسانایی خوب برای گرما و الکتریسیته و چگالی بالا دارند. بسیاری از این فلزات در دمای اتاق جامد هستند، به جز فلزاتی مثل جیوه که به صورت مایع یافت میشوند.
فلزات ساده شامل گروههای مختلف جدول تناوبی میشوند:
- فلزات قلیایی (گروه ۱): مثل لیتیوم، سدیم و پتاسیم که نرم، سبک و بسیار واکنشپذیر هستند و معمولا با آب واکنش شدیدی نشان میدهند.
- فلزات قلیایی خاکی (گروه ۲): مثل منیزیم، کلسیم و استرانسیم که نسبت به فلزات قلیایی کمتر واکنشپذیر هستند ولی همچنان خاصیت فلزی مشخصی دارند و رسانای خوبی برای گرما و برق هستند.
- فلزات واسطه (گروه ۳ تا ۱۲): مثل آهن، مس، نقره، طلا و پلاتین که چندین حالت اکسایش دارند و ترکیبات متنوعی میسازند. این فلزات اغلب چکشخوار و دارای جلای فلزی هستند و نقش مهمی در صنایع و کاتالیزورها دارند.
- فلزات پساواسطه (گروه ۱۳ و پس از آن): مواردی مانند آلومینیوم، قلع و سرب که ویژگیهای فلزی دارند اما نسبت به فلزات واسطه چگالی کمتر و واکنشپذیری متفاوتی دارند.
فلزات پسا واسطه
این فلزات عناصری هستند که خاصیت فلزی دارند و در جدول تناوبی بین فلزات واسطه (گروه ۱۳ و پس از آن) و شبه فلزات قرار گرفتهاند. این فلزات در دمای اتاق در حالت جامد قرار دارند و چگالی بالایی دارند. این فلزات همچنین، هدایت الکتریکی و گرمایی قابل توجهی دارند، چکشخوارند و انعطافپذیری دارند. عناصر فلزی پساواسطه شامل عناصر آلومینیوم، گالیم، ایندیم، قلع، تالیم، سرب و بیسموت هستند.
شبه فلزات
شبهفلزات عناصری هستند که دستهای از خواص فلزات و دستهای از خواص نافلزات را دارند. برای مثال این عناصر میتوانند ظاهری براق داشته باشند اما شکننده باشند. عناصر شبه فلز در جدول تناوبی نیمهرسانا هستند و شامل عناصر بور، سیلیسیم، ژرمانیم، آرسنیک، آنتیموان، تلوریم و پولونیم هستند.
فلزات نجیب
فلزات نجیب شامل روتنیوم (Ru)، اسمیوم (Os)، رودیم (Rh)، ایریدیم (Ir)، پالادیوم (Pd)، پلاتین (Pt)، طلا (Au) و نقره (Ag) هستند. این فلزات مانند گازهای نجیب بیاثر هستند زیرا زیرلایه ظرفیت کامل دارند. همچنین، دارای خواص کاتالیزوری بوده و در برابر خوردگی، تغییر رنگ و اکسیداسیون مقاوم هستند. از نظر ظاهری، نرم و انعطافپذیر هستند.
بلوک s
بلوک s شامل دو ستون اول جدول و هیدروژن و هلیوم است. آرایش الکترونی لایه ظرفیت آنها به صورت است. این عناصر فلزات قلیایی و قلیایی خاکی بوده و ویژگیهایی مانند واکنشپذیری زیاد، نرمی و چگالی پایین دارند.
بلوک p
بلوک p شامل ستونهای ۱۳ تا ۱۸ جدول تناوبی است. آرایش الکترونی لایه ظرفیت آنها به صورت است. عناصر این بلوک ترکیبی از فلزات، شبهفلزات و نافلزات هستند و خواص شیمیایی متنوعی دارند. از جمله این عناصر، هالوژنها و گازهای نجیب هستند.
بلوک d
بلوک d شامل ستونهای ۳ تا ۱۲ جدول تناوبی است. آرایش الکترونی لایه ظرفیت آنها به صورت است. این فلزات چندین حالت اکسایش دارند، رسانای الکتریسیته هستند و جلای فلزی دارند.
بلوک f
بلوک f شامل لانتانیدها و اکتینیدها است. آرایش الکترونی لایه ظرفیت آنها به صورت است. این عناصر فلزات واکنشپذیر، با چگالی بالا و نقطه ذوب و جوش زیاد هستند و برخی از آنها رادیواکتیو هستند.
مکان عناصر گروه f در جدول تناوبی
برای صرفهجویی در فضا، جدول تناوبی اغلب به صورتی نمایش داده میشود که عناصر بلوک f جدا شده و پایین بدنه اصلی قرار میگیرند. این کار تعداد ستونهای جدول را از ۳۲ به ۱۸ کاهش میدهد. هر دو شکل جدول تناوبی یک جدول را نشان میدهند. شکل با بلوک f در بدنه اصلی گاهی «فرم ۳۲ ستونی» یا «بلند» نامیده میشود و شکل با بلوک f جدا شده «فرم ۱۸ ستونی» یا «متوسط-بلند» نامیده میشود.
فرم ۳۲ ستونی مزیت نمایش تمام عناصر در ترتیب صحیح را دارد، اما فضای بیشتری نیاز دارد. انتخاب فرم بیشتر به دلیل مسائل طراحی است و هیچ تغییر علمی در اطلاعات جدول ایجاد نمیکند. تصویر جدول تناوبی بلند در ادامه آورده شده است.

یادگیری شیمی دبیرستان با فرادرس
برای یادگیری مفهوم دوره و گروه در جدول تناوبی، ابتدا باید با مفاهیمی مانند عدد اتمی، آرایش الکترونی، لایههای انرژی و الکترونهای ظرفیت آشنا شویم. شناخت این مفاهیم به ما کمک میکند تا درک کنیم چرا عناصر در هر دوره تعداد لایههای الکترونی یکسان دارند و عناصر در یک گروه رفتار شیمیایی مشابهی از خود نشان میدهند. پیشنهاد میکنیم برای یادگیری بهتر این مسائل و مفاهیم، به مجموعه فیلم آموزش دروس متوسطه دوم و کنکور فرادرس مراجعه کنید که با زبانی ساده ولی کاربردی به توضیح این مفاهیم میپردازد.
همچنین با مراجعه به فیلمهای آموزش فرادرس که در ادامه آورده شده است، میتوانید به آموزشهای بیشتری در زمینه دوره و گروه در جدول تناوبی دسترسی داشته باشید.
خواص دورهای عناصر در دوره و گروه جدول تناوبی
در جدول تناوبی، با حرکت در طول دورهها (ردیفهای افقی) و گروهها (ستونهای عمودی)، خواص عناصر بهصورت منظم تغییر میکند. در دورهها، عدد لایه الکترونی ثابت است ولی تعداد الکترونهای ظرفیت افزایش مییابد. در گروهها، تعداد الکترونهای ظرفیت ثابت میماند اما تعداد لایهها زیاد میشود.
این تغییرات باعث ایجاد خواص دورهای مانند شعاع اتمی، انرژی یونش، الکترون خواهی، الکترونگاتیوی، خصلت فلزی و فعالیت شیمیایی میشود. در ادامه تغییر هریک از این خواص دورهای را در دوره و ردیف توضیح میدهیم.
- شعاع اتمی: در یک دوره از چپ به راست کاهش مییابد. در یک گروه از بالا به پایین افزایش مییابد.
- انرژی یونش: در یک دوره از چپ به راست افزایش مییابد. در یک گروه از بالا به پایین کاهش مییابد.
- الکترون خواهی: در یک دوره معمولا افزایش مییابد. در یک گروه از بالا به پایین کاهش مییابد.
- الکترونگاتیوی: در یک دوره افزایش مییابد. در یک گروه کاهش مییابد.
- خاصیت فلزی: در یک دوره از چپ به راست کاهش مییابد. در یک گروه از بالا به پایین افزایش مییابد.
- فعالیت شیمیایی فلزات: در یک دوره کاهش مییابد. در یک گروه افزایش مییابد.
- فعالیت شیمیایی نافلزات: در یک دوره افزایش مییابد. در یک گروه کاهش مییابد.
source
